Для подростков и взрослых с атопическим дерматитом в средней и тяжелой форме в России стала доступна терапия препаратом «Сайбинкью»
Министерством здравоохранения РФ был одобрен[1] препарат «Сайбинкью» (аброцитиниб), пероральный ингибитор янус-киназы 1-го типа (JAK 1), для лечения атопического дерматита (АтД) средней и тяжелой степени тяжести у взрослых и подростков в возрасте от 12 до 18 лет, которым показана системная терапия. Регистрация препарата была основана на результатах пяти рандомизированных клинических исследований (КИ). Ранее, в сентябре 2021 года, аброцитиниб был зарегистрирован для лечения АтД у той же категории пациентов в Великобритании [2], в декабре 2021 года он был одобрен Европейской комиссией[3], а в начале 2022 года — Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в США[4].
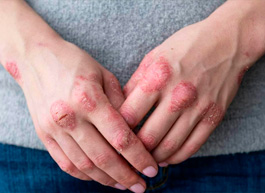 Атопический дерматит — это распространенное (от 20% до 40% в структуре кожных заболеваний[5]) хроническое воспалительное заболевание кожи, которое характеризуется зудом и сухостью и обычно поражает лицо (щеки), шею, верхние и нижние конечности[6]. АтД является одним из наиболее часто встречаемых неинфекционных заболеваний – им страдают до 20% детей и от 2 до 8% взрослых в большинстве стран мира[7]. В 2020 году в России распространенность атопического дерматита была зарегистрирована на уровне 379,5 на 100 тыс. населения, а показатель заболеваемости составил 158,3 на 100 тыс[8]. Вызывая ощутимый дискомфорт и явные внешние проявления, АтД оказывает негативное влияние на качество жизни, ментальное благополучие и социализацию пациентов. Так, около 39% подростков с этим диагнозом сталкиваются с буллингом из-за заболевания, около половины испытывают апатию и подавленность, более трети неудовлетворены своим внешним видом[9].
Атопический дерматит — это распространенное (от 20% до 40% в структуре кожных заболеваний[5]) хроническое воспалительное заболевание кожи, которое характеризуется зудом и сухостью и обычно поражает лицо (щеки), шею, верхние и нижние конечности[6]. АтД является одним из наиболее часто встречаемых неинфекционных заболеваний – им страдают до 20% детей и от 2 до 8% взрослых в большинстве стран мира[7]. В 2020 году в России распространенность атопического дерматита была зарегистрирована на уровне 379,5 на 100 тыс. населения, а показатель заболеваемости составил 158,3 на 100 тыс[8]. Вызывая ощутимый дискомфорт и явные внешние проявления, АтД оказывает негативное влияние на качество жизни, ментальное благополучие и социализацию пациентов. Так, около 39% подростков с этим диагнозом сталкиваются с буллингом из-за заболевания, около половины испытывают апатию и подавленность, более трети неудовлетворены своим внешним видом[9].
Одобрение «Сайбинкью» было основано на результатах пяти рандомизированных клинических исследований с участием более 2800 пациентов, включая четыре исследования 3-й фазы и продолжающееся долгосрочное открытое расширенное исследование. Аброцитиниб продемонстрировал значительное улучшение показателей облегчения симптомов и контроля заболевания по сравнению с плацебо. В исследованиях также оценивались эффективность и безопасность применения аброцитиниба (100 мг и 200 мг один раз в сутки) в комбинации с топическими кортикостероидами и без них у взрослых и подростков с атопическим дерматитом от средней до тяжелой степени, которым показана системная терапия: препарат достиг первичных и вторичных конечных точек в исследованиях у разных групп пациентов.
Дополнительные сведения о программе клинических исследований препарата «Сайбинкью»
Результаты следующих пяти исследований в рамках глобальной программы разработки «Сайбинкью» JAK1 Atopic Dermatitis Efficacy and Safety (JADE) были включены в заявку на одобрение препарата. В КИ оценивали показатели улучшения состояния пациентов с АтД, включая общую оценку исследователя (IGA), индекс распространенности и тяжести экземы (EASI) и числовую рейтинговую шкалу максимального зуда (PP-NRS):
- JADE MONO-1 и JADE MONO-2: два рандомизированных, двойных слепых, плацебо-контролируемых исследования, разработанных для оценки эффективности и безопасности двух доз (100 мг и 200 мг один раз в день) монотерапии «Сайбинкью» у 778 пациентов в возрасте 12 лет и старше со среднетяжелой и тяжелой формой АтД. В исследованиях оценивались сопутствующие первичные конечные точки ответов IGA и EASI-75 на 12-й неделе. Доля пациентов, достигших ответа по шкале IGA в MONO-1, была значительно выше в группе аброцитиниба, чем в группе плацебо: в дозировке 100 мг — 24% против 8% (p=0·0037), соответственно, в дозировке 200 мг — 44% против 8% (р<0·0001)[10]. Более высокие результаты в группе аброцитиниба были достигнуты и в отношении ответа по EASI-75: для дозировки 100 мг — 40% против 12%, соответственно (р<0,0001), для группы 200 мг — 63% против 12% (р<0,0001)10. В рамках КИ MONO-2 препарат также получил более высокие, по сравнению с плацебо, результаты: у пациентов в группах аброцитиниба в дозировках 200 и 100 мг был достигнут ответ по IGA 38,1% и 28,4% против 9,1% в группе плацебо (P< 0,001); по EASI-75 — 61,0%, 44,5% против 10,4%, соответственно (P < 0,001)[11].
- В исследовании JADE COMPARE среди взрослых пациентов со средней и тяжелой степенью тяжести заболевания, которым показана системная терапия, оценивались пациенты, получавшие фоновую местную медикаментозную терапию. КИ также включало активную контрольную группу с биологическим препаратом дупилумаб. В рамках анализа были достигнуты высокие результаты в отношении уменьшения проявления клинических признаков и симптомов АтД. На 12-й неделе терапии положительный ответ по шкале IGA наблюдался у 48,4% пациентов в группе аброцитиниба в дозе 200 мг, у 36,6% в группе аброцитиниба в дозе 100 мг, у 36,5% в группе дупилумаба и 14,0% в группе плацебо (Р<0,001 для обеих доз аброцитиниба по сравнению с плацебо)[12]. Кроме того, положительный ответ по индексу EASI-75 на 12-й неделе наблюдался у 70,3%, 58,7%, 58,1% и 27,1%, соответственно (Р<0,001 для обеих доз аброцитиниба по сравнению с плацебо)12. Превосходство аброцитиниба в дозе 200 мг по сравнению с дупилумабом на 2-й неделе было показано для доли пациентов, достигших улучшения по крайней мере на 4 балла по шкале PP-NRS со значительно более высоким облегчением зуда уже на 4-й день после первой дозы препарата[12].
- Препарат также показал более низкую по сравнению с плацебо вероятность возникновения обострения при непрерывном приеме терапии в исследовании JADE REGIMEN: более чем в 4 раза ниже для дозировки 200 мг и почти в 2 раза – для дозировки 100 мг, что составило 18,9% и 42,6% соответственно против 80,9% у пациентов, принимавших плацебо[13].
- JADE EXTEND: продолжающееся крупное открытое исследование, предназначенное для оценки долгосрочной безопасности и эффективности «Сайбинкью» в течение 92-недельного начального периода лечения, за которым следует период вторичного лечения различной продолжительности, в течение которого пациенты будут получать лечение аброцитинибом в открытом режиме[14].
В прямом сравнительном рандомизированном исследовании у взрослых пациентов JADE DARE было показано, что аброцитиниб статистически превосходил дупилумаб по каждому оцениваемому показателю эффективности и имел профиль безопасности, соответствующий предыдущим исследованиям. Данное исследование было разработано для оценки эффективности и безопасности аброцитиниба в дозе 200 мг по сравнению с дупилумабом в дозе 300 мг у взрослых пациентов со среднетяжелым и тяжелым АтД, получавших базовую наружную терапию.[15] Основной конечной точкой исследования была оценка уменьшения степени тяжести зуда на второй неделе. Аброцитиниб приводил к значительно более быстрому уменьшению признаков и симптомов заболевания по сравнению с дупилумабом (ответ по EASI-90 на неделе 16 составил 54% против 42%, p=0·0008). Аброцитиниб в комбинации с наружной лекарственной терапией обеспечивал быстрое и более выраженное облегчение зуда и очищение кожи, чем дупилумаб, которые сохранялись в течение 26 недель у пациентов15.
Эффективность аброцитиниба в дозировке 100 мг и 200 мг в сочетании с наружной медикаментозной терапией в течение 12 недель у подростков была подтверждена в двойном слепом плацебо-контролируемом исследовании III фазы JADE TEEN[16]. Исследование достигло свои первичные и вторичные конечные точки эффективности: на неделе 12 у значительно большей доли пациентов, получавших аброцитиниб (200 мг или 100 мг) в сочетании с местной терапией по сравнению с плацебо в сочетании с местной терапией, достигнуты ответы IGA 0/1 (46,2 %; 41,6 % против 24,5 %; p < 0,05 для обеих групп), EASI-75 (72,0 %; 68,5 % против 41,5 %; p < 0,05 для обеих групп).16 Более выраженное улучшение качества жизни пациентов-подростков и лиц, осуществляющих уход за ними, наблюдалось в группах обеих доз аброцитиниба в сочетании с местной терапией в сравнении с плацебо в сочетании с местной терапией на неделях 2–1216. Результаты переносимости и безопасности терапии подтвердили, что аброцитиниб в комбинации с местной терапией не оказывает неблагоприятного воздействия на соотношение «риск-польза» у подростков. Частота серьезных и тяжелых нежелательных явлений была аналогичной или ниже в группах аброцитиниба, чем в группе плацебо16.
Препарат продемонстрировал благоприятный профиль безопасности во всех клинических исследованиях. Большинство побочных эффектов, возникших во время исследований аброцитиниба у взрослых пациентов, были легкими или умеренными, наиболее распространенные из них — тошнота и акне12. Кроме того в рамках исследования JADE REGIMEN было отмечено, что в группе поддерживающей терапии аброцитинибом в дозировке 100 мг было зарегистрировано меньшее количество побочных эффектов, связанных с лечением, по сравнению с группой, принимавшей препарат в дозировке 200 мг, что свидетельствует о зависимости дозировки от возникновения побочных эффектов13. Данный фактор рассматривается для оценки соотношения пользы и риска для определения наилучшей поддерживающей дозировки для определенных групп пациентов, особенно среди тех, кто имеет сопутствующие заболевания или более высокий риск развития инфекций13.
По результатам клинических исследований, терапия аброцитинибом существенно улучшала показатели облегчения симптомов и контроля заболевания, качества жизни пациентов с различным анамнезом 10–16. Так, благоприятный профиль безопасности новой терапии и низкая вероятность развития обострения заболевания не только поможет пациентам бороться с клиническими проявлениями АтД, но и позволит в перспективе снизить уровень тревоги и психологического дискомфорта по причине заболевания. Регистрация препарата «Сайбинкью», который будет доступен в РФ в дозировках 50 мг, 100 мг и 200 мг, позволит сделать жизнь сотен тысяч пациентов с атопическим дерматитом в стране более комфортной.
КРАТКАЯ ИНСТРУКЦИЯ ПО МЕДИЦИНСКОМУ ПРИМЕНЕНИЮ ЛЕКАРСТВЕННОГО ПРЕПАРАТА САЙБИНКЬЮ
Международное непатентованное наименование: Аброцитиниб; Лекарственная форма: таблетки, покрытые пленочной оболочкой 50 мг, 100 мг и 200 мг. Состав: каждая таблетка содержит: действующее вещество: аброцитиниб 50/100/200 мг.
Фармакотерапевтическая группа: другие препараты, применяемые в дерматологии; средства для лечения дерматита, кроме кортикостероидов.
Код АТХ: D11AH08.
Фармакологические свойства.
Аброцитиниб представляет собой ингибитор Янус-киназы 1-го типа (JAK1). Янус-киназы — внутриклеточные ферменты, которые передают сигналы, генерируемые в результате взаимодействия цитокина или фактора роста с рецептором на клеточной мембране, влияя на клеточные процессы гематопоэза и функционирования клеток иммунной системы. В рамках сигнального пути JAK фосфорилируют и активируют передатчики сигнала и активаторы транскрипции (Signal Transducers and Activators of Transcription — STAT), которые модулируют внутриклеточную активность, включая экспрессию генов. Аброцитиниб модулирует этот сигнальный путь, воздействуя на JAK1 и предотвращая фосфорилирование и активацию STAT. Аброцитиниб обратимо и избирательно ингибирует JAK1, блокируя участок связывания аденозинтрифосфата (АТФ). В бесклеточном изолированном ферментативном анализе аброцитиниб проявлял биохимическую избирательность к JAK1 среди других изоформ JAK (JAK2 (в 28 раз), JAK3 (в > 340 раз) и тирозинкиназы (TYK) 2 (в 43 раза). Исходное соединение и его активные метаболиты ингибируют цитокиновые сигнальные пути с одинаковой степенью избирательности.
Показания к применению.
Препарат Сайбинкью применяется для лечения атопического дерматита средней и тяжелой степени тяжести у взрослых и подростков в возрасте от 12 до 18 лет, которым показана системная терапия.
Противопоказания: Гиперчувствительность к аброцитинибу или к любому из вспомогательных веществ. Пациентам с редко встречающейся наследственной непереносимостью галактозы, дефицитом лактазы лопарей или глюкозо-галактозной мальабсорбцией не следует принимать этот препарат. Беременность. Период грудного вскармливания.
Режим дозирования и способ применения:
Лечение препаратом Сайбинкью должно начинаться и проводиться под контролем лечащего врача, имеющего опыт в диагностике и лечении заболеваний, по поводу которых назначается Сайбинкью.
Рекомендуемая доза препарата Сайбинкью при лечении взрослых пациентов с атопическим дерматитом средней и тяжелой степени тяжести составляет 100 мг или 200 мг 1 раз в сутки, исходя из индивидуальной цели лечения и потенциального риска нежелательных реакций.
Препарат Сайбинкью можно применять в сочетании с лекарственными препаратами для лечения атопического дерматита для местного применения или в качестве монотерапии. Если после 24 недель лечения достаточная терапевтическая эффективность лечения препаратом Сайбинкью не достигнута, следует рассмотреть возможность его отмены.
Препарат Сайбинкью не следует назначать пациентам с числом тромбоцитов <150 × 103/мм3, абсолютным числом лимфоцитов (АЧЛ) < 0,5 × 103/мм3, абсолютным числом нейтрофилов (АЧН) < 1 ×103/мм3 или концентрацией гемоглобина < 8 г/дл.
Пропуск дозы.
Если прием дозы препарата пропущен, пациентам следует принять препарат как можно скорее, но не позднее чем за 12 часов до приема следующей дозы — в противном случае пропущенную дозу принимать не следует. После этого лечение продолжают по обычной схеме.
Временное прекращение лечения.
Если у пациента развивается серьезная инфекция, сепсис или оппортунистическая инфекция, следует рассмотреть целесообразность отмены препарата Сайбинкью до достижения контроля над инфекцией. При отклонении от нормы результатов лабораторных показателей может потребоваться временная отмена препарата.
Пациентам с легким нарушением функции почек (т. е. при расчетной скорости клубочковой фильтрации (рСКФ) от 60 до < 90 мл/мин) коррекция дозы препарата не требуется, у пациентов со средним (рСКФ от 30 до < 60 мл/мин) и тяжелым нарушением функции почек (рСКФ < 30 мл/мин) рекомендованную дозу препарата Сайбинкью следует снижать на 50 %. Применение препарата Сайбинкью не изучалось у пациентов с почечной недостаточностью терминальной стадии, находящихся на диализе. Нарушение функции печени. У пациентов с нарушением функции печени легкой (класс А по классификации Чайлд — Пью) или средней степени (класс В по классификации Чайлд — Пью) коррекция дозы препарата не требуется.
Препарат Сайбинкью не изучался у пациентов с нарушением функции печени тяжелой степени (класс С по классификации Чайлд — Пью), поэтому в этой группе пациентов его применять не рекомендуется. Пациенты пожилого возраста. Коррекция дозы для пациентов в возрасте ≥ 65 лет не требуется.
Данные о применении препарата у пациентов в возрасте 75 лет и старше ограничены. Дети. Режим дозирования для детей от 12 до 18 лет не отличается от режима дозирования для взрослых. Безопасность и эффективность препарата Сайбинкью у детей в возрасте от 0 до 12 лет не установлены. Способ применения. Препарат Сайбинкью следует принимать внутрь один раз в сутки примерно в одно и то же время каждый день вне зависимости от приема пищи. Если при приеме препарата Сайбинкью возникает тошнота, снизить степень ее выраженности возможно приемом препарата с пищей. Таблетки Сайбинкью следует проглатывать целиком, запивая водой, не разделяя, не раздавливая и не разжевывая их.
Нежелательные реакции.
Резюме профиля безопасности. Наиболее частыми нежелательными реакциями, которые возникали у ≥ 2 % пациентов, принимавших препарат Сайбинкью в плацебо-контролируемых исследованиях, были тошнота (10,3 %), головная боль (6,8 %), простой герпес (3,8 %), акне (3,2 %), повышение уровня креатинфосфокиназы в крови (2,6 %), головокружение (2,3 %) и рвота (2,3 %). Наиболее частыми серьезными нежелательными реакциями у пациентов с атопическим дерматитом были инфекции. Инфекции и инвазии: часто – простой герпес, нечасто – опоясывающий герпес; нарушения со стороны крови и лимфатической системы: нечасто
– тромбоцитопения, лимфопения; нарушения метаболизма и питания: нечасто – гиперлипидемия; со стороны нервной системы: часто – головная боль, головокружение; со стороны сосудов: нечасто – венозная тромбоэмболия; желудочно-кишечные нарушения: очень часто – тошнота, часто – рвота, боль в верхней части живота; нарушения со стороны кожи и подкожных тканей: часто – акне; лабораторные и инструментальные данные: часто – повышение уровня креатинфосфокиназы. Пациенты пожилого возраста. Профиль безопасности препарата у пациентов пожилого возраста был аналогичен его профилю безопасности у взрослых в целом. Дети. Фармакокинетика, безопасность и эффективность препарата Сайбинкью у пациентов в возрасте младше 12 лет не установлена. Профиль безопасности препарата в исследованиях с участием подростков с атопическим дерматитом был аналогичен его профилю безопасности у взрослых.
Особые указания и меры предосторожности при применении.
Серьезные инфекции. Сообщалось о возникновении серьезных инфекций у пациентов, принимающих препарат Сайбинкью. Наиболее частыми серьезными инфекциями в клинических исследованиях были простой герпес, опоясывающий герпес и пневмония. У пациентов с активными, хроническими или рецидивирующими инфекциями до начала лечения следует тщательно взвесить риски и пользу от лечения препаратом Сайбинкью. Во время лечения препаратом Сайбинкью и после его окончания за пациентами следует вести тщательное наблюдение с целью выявления признаков и симптомов инфекции. Пациенту, у которого во время лечения препаратом Сайбинкью развивается новая инфекция, следует провести срочное полное диагностическое обследование и назначить подходящую антимикробную терапию. За пациентом должно осуществляться тщательное наблюдение, а при неэффективности стандартной терапии препарат Сайбинкью следует отменить. Туберкулез. Перед началом лечения препаратом Сайбинкью пациентам следует пройти скрининг на туберкулез; для пациентов, живущих в высоко эндемичных регионах по туберкулезу, следует рассмотреть целесообразность ежегодного скрининга. Препарат Сайбинкью не следует назначать пациентам с активным туберкулезом. Пациентам с новым диагнозом латентного туберкулеза или ранее не леченным латентным туберкулезом перед началом лечения препаратом Сайбинкью следует назначить профилактическое лечение по поводу латентного туберкулеза. Реактивация вируса. Сообщалось о случаях реактивации вирусов, включая вирус герпеса (в частности, опоясывающего герпеса и простого герпеса) в клинических исследованиях. Частота возникновения инфекций, опосредованных вирусом опоясывающего герпеса, была выше у пациентов в возрасте 65 лет и старше. Перед началом и во время лечения препаратом Сайбинкью должен проводиться скрининг на вирусный гепатит в соответствии с клиническими рекомендациями. Пациенты с признаками активных инфекций гепатита В или гепатита С (с положительным результатом ПЦР на гепатит С) исключались из клинических исследований. Пациенты с отрицательным результатом исследования на поверхностный антиген вируса гепатита B, положительным результатом исследования на антитела к сердцевинному антигену вируса гепатита В и положительным результатом исследования на антитела к поверхностному антигену вируса гепатита B проходили исследование на ДНК вируса гепатита В (hepatitis B virus — HBV). Пациенты, у которых обнаруживалась ДНК HBV на уровне выше нижнего предела количественного определения (НПКО), исключались из клинических исследований. Пациенты с отрицательным результатом исследования на ДНК HBV или результатом ниже НПКО могли начать лечение препаратом Сайбинкью, при этом у них производился мониторинг ДНК HBV. При обнаружении у пациента ДНК HBV следует проконсультироваться с гепатологом. Вакцинация. Во время лечения препаратом Сайбинкью и непосредственно перед началом его использования не рекомендуется вакцинация живыми ослабленными вакцинами. До начала лечения препаратом Сайбинкью пациентам рекомендуется сделать все необходимые прививки в соответствии с действующими рекомендациями по проведению профилактической вакцинации, в том числе прививку от герпетической инфекции.
Венозная тромбоэмболия. Сообщалось о возникновении явлений тромбоза глубоких вен (ТГВ) и тромбоэмболии легочной артерии (ТЭЛА) у пациентов, принимающих ингибиторы янус-киназ, включая препарат Сайбинкью. При применении препарата Сайбинкью пациентами с высоким риском возникновения ТГВ/ТЭЛА следует соблюдать осторожность. Факторы риска, которые следует учитывать при определении риска возникновения ТГВ/ТЭЛА, включают в себя пожилой возраст, ожирение, наличие в анамнезе ТГВ/ТЭЛА, протромботического расстройства, прием комбинированных гормональных контрацептивов или гормонозаместительная терапия, обширное хирургическое вмешательство и длительную иммобилизацию. При возникновении клинических признаков ТГВ/ТЭЛА лечение препаратом Сайбинкью следует прекратить; пациентам следует провести срочное обследование, а затем назначить подходящее лечение.
Злокачественные новообразования (включая немеланомный рак кожи).
В клинических исследованиях препарата Сайбинкью наблюдались случаи злокачественных новообразований (включая немеланомный рак кожи (НМРК)). Имеется недостаточно клинических данных для оценки потенциальной связи между лечением препаратом Сайбинкью и развитием злокачественных новообразований. В настоящий момент продолжается оценка его долгосрочной безопасности. Перед назначением препарата Сайбинкью пациентам со злокачественными новообразованиями, не относящимися к успешно вылеченному НМРК и раку шейки матки in situ, и при рассмотрении целесообразности продолжения лечения препаратом Сайбинкью у пациентов, у которых возникло злокачественное новообразование, следует рассмотреть риски и пользу от лечения препаратом Сайбинкью. Пациентам с повышенным риском возникновения рака кожи рекомендуется проводить периодическое обследование кожи.
Отклонения от нормы результатов общего анализа крови. В клинических исследованиях подтвержденные эпизоды АЧЛ < 0,5 × 103/мм3 и числа тромбоцитов < 50 × 103/мм3 были зарегистрированы менее чем у 0,5 % пациентов. Препарат Сайбинкью не следует назначать пациентам с числом тромбоцитов < 150 × 103/мм3, АЧЛ < 0,5 × 103/мм3, АЧН < 1 × 103/мм3 или концентрацией гемоглобина < 8 г/дл. Число тромбоцитов и АЧЛ следует оценивать примерно после 4 недель лечения препаратом Сайбинкью и далее в соответствии с плановым ведением пациента. Если число тромбоцитов составляет < 50 × 103/мм3, лечение следует отменить. Если АЧЛ < 0,5 × 103/мм3, лечение следует временно отменить. Его можно возобновить, как только АЧЛ будет выше этого значения. При подтверждении лечение следует отменить.
Липиды. Сообщалось о случаях повышения уровня липидов в крови при лечении препаратом Сайбинкью, степень выраженности которых зависела от дозы. Параметры липидного обмена следует оценивать примерно после 4 недель лечения препаратом Сайбинкью; далее ведение пациентов следует осуществлять в соответствии с клиническими руководствами по лечению гиперлипидемии. Влияние повышения показателей содержания липидов на частоту сердечно-сосудистых осложнений и смертность определено не было.
Фертильность, беременность и лактация. Женщины с детородным потенциалом. Женщинам с сохраненной репродуктивной функцией следует порекомендовать применять эффективную контрацепцию во время лечения препаратом Сайбинкью и в течение 1 месяца после приема последней дозы. Женщинам с сохраненной репродуктивной функцией следует рассмотреть планирование и предупреждение беременности.
Беременность. Данные о применении препарата Сайбинкью у беременных женщин ограничены или отсутствуют. Исследования на животных продемонстрировали его репродуктивную токсичность. Было показано, что препарат Сайбинкью приводит к изменениям скелета у беременных крыс и кроликов и влияет на роды, а также перинатальное и постнатальное развитие у беременных крыс. Препарат Сайбинкью противопоказан при применении во время беременности.
Лактация. Отсутствуют данные о выделении препарата Сайбинкью (или его метаболитов) с грудным молоком, влиянии на детей, находящихся на грудном вскармливании, а также влиянии на выработку молока. Препарат Сайбинкью выделялся в грудное молоко у лактирующих крыс. Риск для новорожденных/грудных детей исключить невозможно; препарат Сайбинкью противопоказан женщинам в период грудного вскармливания.
Фертильность. Исходя из результатов исследований на крысах, применение препарата Сайбинкью внутрь может приводить к временному снижению фертильности у женщин с сохраненной репродуктивной функцией. Влияние на фертильность самок крыс было обратимым через 1 месяц после прекращения перорального введения препарата Сайбинкью.
Влияние на способность управлять транспортными средствами и работать с механизмами. Препарат Сайбинкью не оказывает влияния на способность управлять транспортными средствами и работать с механизмами или влияет на нее в незначительной степени. Пациенты должны быть предупреждены о возможности развития головокружения. При появлении головокружения следует воздержаться от выполнения указанных видов деятельности.
Характер и содержание первичной упаковки.
По 14 или 30 таблеток помещают во флаконы из полиэтилена высокой плотности (ПЭВП) с полипропиленовой крышкой и уплотнителем (алюминиевая фольга/полиэтилен). По 1 флакону вместе с листком-вкладышем помещают в картонную пачку с контролем первого вскрытия. По 7 таблеток помещают в блистер из ПВХ/ПВДХ с покрытием из алюминиевой фольги. По 2, или 4, или 13 блистеров вместе с листком-вкладышем помещают в картонную пачку с контролем первого вскрытия.
Срок годности (срок хранения). 2 года.
Особые меры предосторожности при хранении. Хранить при температуре ниже 30 ºС. Хранить в оригинальной первичной упаковке (блистере и флаконе).
Условия отпуска. Отпускают по рецепту.
ЛП-№ (001123)-(РГ-RU) – 11082022.
[1] ЛП-№ (001123)-(РГ-RU) – 11082022
[2] Cibinqo (abrocitinib) UK Summary of Product Characteristics (Sep 2021). https://www.medicines.org.uk/emc/product/12873/smpc#gref
[3] AP News. European Commission Approves Pfizer’s Cibinqo® (abrocitinib) for the Treatment of Adults with Moderate-to-Severe Atopic Dermatitis. https://apnews.com/press-release/BusinessWire/business-health-europe-european-commission-pfizer-inc-95a8f17418364ec0b4d5a466944914d6
[4] Bloomberg. U.S. FDA Approves Pfizer’s CIBINQO® (abrocitinib) for Adults with Moderate-to-Severe Atopic Dermatitis. https://www.bloomberg.com/press-releases/2022-01-14/u-s-fda-approves-pfizer-s-cibinqo-abrocitinib-for-adults-with-moderate-to-severe-atopic-dermatitis
[5] Клинические рекомендации. Атопический дерматит. 2020. https://www.nrcii.ru/specialistam/klinrecommend/atopic_dermatitis_2020.pdf
[6] NIH. Atopic Dermatitis. https://www.niams.nih.gov/health-topics/atopic-dermatitis
[7] Wollenberg A., Barbarot S., Bieber T. et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I.J Eur Acad Dermatol Venereol. 2018
[8] Вестник дерматологии и венерологии. Итоги деятельности медицинских организаций, оказывающих медицинскую помощь по профилю дерматовенерология, в 2020 году: работа в условиях пандемии https://vestnikdv.ru/jour/article/view/1261
[9] Медвестник. Атопический дерматит в практике детского дерматолога. https://medvestnik.ru/content/medarticles/Atopicheskii-dermatit-v-praktike-detskogo-dermatologa.html
[10] Eric L Simpson et al. Efficacy and safety of abrocitinib in adults and adolescents with moderate-to-severe atopic dermatitis (JADE MONO-1): a multicentre, double-blind, randomised, placebo-controlled, phase 3 trial
[11] Jonathan I. Silverberg et al. JAMADermatology. Efficacy and Safety of Abrocitinib in Patients With Moderate-to-Severe Atopic Dermatitis A Randomized Clinical Trial.
[12] T. Bieber et al. Abrocitinib versus Placebo or Dupilumab for Atopic Dermatitis. https://www.nejm.org/doi/pdf/10.1056/NEJMoa2019380?articleTools=true
[13] Andrew Blauvelt et al. Abrocitinib induction, randomized withdrawal, and retreatment in patients
with moderate-to-severe atopic dermatitis: Results from the JAK1 Atopic Dermatitis Efficacy and Safety (JADE) REGIMEN phase 3 trial. https://pubmed.ncbi.nlm.nih.gov/34416294/
[14] Vivian Y.Shi et al. Phase 3 efficacy and safety of abrocitinib in adults with moderate-to-severe atopic dermatitis after switching from dupilumab (JADE EXTEND). J Am Acad Dermatol. 2022 Aug;87(2):351-358. doi: 10.1016/j.jaad.2022.04.009
[15] Efficacy of abrocitinib vs. dupilumab in adults with moderate-to-severe atopic dermatitis who had an inadequate response or intolerance to nonsteroidal immunosuppressants: results from JADE DARE
[16] Lawrence F. Eichenfield et al. Efficacy and Safety of Abrocitinib in Combination With Topical Therapy
in Adolescents With Moderate-to-Severe Atopic Dermatitis The JADE TEEN Randomized Clinical Trial
- Поделиться:
Главный редактор — Т. Ю. Ходанович. Тел: +7 (495) 120-44-34, email: hello@pharmedu.ru
Публикация № P-35922