Влияние омега-3 ненасыщенных жирных кислот на протеом плазмы при синдроме Ретта
1. Введение
Внимание к омега-3 полиненасыщенным жирным кислотам (ω-3 ПНЖК) со стороны научного сообщества и широких масс растет на основании того, что эти натуральные молекулы обладают способностью положительно воздействовать на большинство состояний, в частности, благодаря их способности предотвращать сердечно-сосудистые заболевания. Самыми распространенными ω-3 ПНЖК являются эйкозапентаеновая кислота (ЭПК) и докозагексаеновая кислота (ДГК), обнаруженные в рыбьем жире, а также альфа-линоленовая кислота C18:3 n-3, полученная из растений. Гипотриглицеридемический эффект – наиболее определенная метаболическая реакция ω-3 ПНЖК [1], механизм которой, очевидно, связан с активацией рецепторов, активируемых пролифератором пероксисом [2]. О множестве других потенциальных положительных эффектах ω-3 ПНЖК можно только догадываться. Помимо доказанного или предполагаемого положительного воздействия на сердечно-сосудистую систему (снижение восприимчивости к желудочковой аритмии [3]; антитромбогенный и антиоксидантный эффект [4]; замедление роста атеросклеротических бляшек путем снижения экспрессии адгезивных молекул и фактора роста тромбоцитов [4]; содействие эндотелиальному фактору релаксации путем стимулирования производства окиси азота; а также слабый гипотензивный эффект [5]), также был отмечен более общий, как прямой, так и косвенный, противовоспалительный эффект [6-8]. Тем не менее, молекулярные механизмы, лежащие в основе эффектов ω-3 ПНЖК при регуляции воспалительных процессов все еще слабо изучены и являются основной областью исследования [9-11]. Несколько факторов, включая тип ПНЖК, образование, дозу, продолжительность, возраст и основное заболевание исследуемых субъектов, а также – последнее, но не наименее важное – объективное измерение эффектов, могут способствовать пониманию данного вопроса, связанного с липидным обменом.Однако, относительно недавний отчет, посвященный взрослым курильщикам [12], показал, что ω-3 ПНЖК способны оказать влияние на экспрессию белков плазмы крови путем регуляции острофазного ответа (ОФО).
 Синдром Ретта (СР) – это разрушительное расстройство, связанное с неврологическим развитием, главным образом, вызванное спорадическими мутациями в гене, кодирующем метил-CpG-связывающий белок 2 (MeCP2). СР чаще всего поражает лиц женского пола с частотностью 1:10 000 живорожденных девочек и считается второй по распространенности причиной тяжелых когнитивных нарушений, свойственных этому полу [13]. СР ранее входил в число расстройств аутистического спектра (РАС), хотя существуют очевидные различия с аутизмом [14], и сейчас он не относится к группе РАС. Тем не менее, кратковременные аутистические черты всегда присутствуют в ходе естественного развития СР. Таким образом, это относительно редкое заболевание на самом деле дает замечательную возможность объективно испытать воздействие ω-3 ПНЖК на аутистическое состояние, принимая во внимание, что: (1) был выявлен устойчивый окислительно-восстановительный дисбаланс [15]; (2) ω-3 ПНЖК были предложены для снижения тяжести фенотипических проявлений и улучшения окислительно-восстановительного баланса у пациентов, получающих добавки, на нескольких стадиях болезни [15]; (3) сниженный метаболизм холестерина недавно был доказан у мышей с СР при отсутствии MeCP2 в случае лечения статинами, что приводит к улучшению моторных симптомов и повышает продолжительность жизни [16]; и (4) в нашей группе пациентов с СР наблюдались случаи необъяснимой гиперхолестеринемии [17].
Синдром Ретта (СР) – это разрушительное расстройство, связанное с неврологическим развитием, главным образом, вызванное спорадическими мутациями в гене, кодирующем метил-CpG-связывающий белок 2 (MeCP2). СР чаще всего поражает лиц женского пола с частотностью 1:10 000 живорожденных девочек и считается второй по распространенности причиной тяжелых когнитивных нарушений, свойственных этому полу [13]. СР ранее входил в число расстройств аутистического спектра (РАС), хотя существуют очевидные различия с аутизмом [14], и сейчас он не относится к группе РАС. Тем не менее, кратковременные аутистические черты всегда присутствуют в ходе естественного развития СР. Таким образом, это относительно редкое заболевание на самом деле дает замечательную возможность объективно испытать воздействие ω-3 ПНЖК на аутистическое состояние, принимая во внимание, что: (1) был выявлен устойчивый окислительно-восстановительный дисбаланс [15]; (2) ω-3 ПНЖК были предложены для снижения тяжести фенотипических проявлений и улучшения окислительно-восстановительного баланса у пациентов, получающих добавки, на нескольких стадиях болезни [15]; (3) сниженный метаболизм холестерина недавно был доказан у мышей с СР при отсутствии MeCP2 в случае лечения статинами, что приводит к улучшению моторных симптомов и повышает продолжительность жизни [16]; и (4) в нашей группе пациентов с СР наблюдались случаи необъяснимой гиперхолестеринемии [17].
Поскольку изучение протенома плазмы при СР проводилось в ходе лишь одного исследования [18], мы предполагаем, что ω-3 ПНЖК могут оказывать влияние на протеном плазмы при СР путем модуляции ОФО.
2. Материалы и методы
2.1. Участники исследования.
Исследование проводилось с участием 24 пациентов женского пола с клиническим диагнозом «типичный синдром Ретта» (средний возраст 14,4 ± 8,0 лет, возрастной диапазон – 4-33 года) с ярко выраженной мутацией гена MECP2 [т.е. T158 M (n = 5), делеция C-концевого сегмента (n = 4), R255X (n = 4), R270X (n = з), R133C (n = 2), ранние мутации усечения (n = 1), обширные делеции (n = 1) другие мутации (n = 4)].Распределение клинических стадий было следующим: стадия I (n = 4), стадия II (n = 6), стадия III (n = 7), и стадия IV (n = 7).Диагноз СР и критерии включения/невключения основаны на недавно пересмотренной согласованной терминологии СР [19, 20]. Все пациенты были признаны Национальным справочным центром по синдрому Ретта Университетской больницы Сиены (заведующий – профессор Йосеф Хаек).
Образцы крови в группе пациентов были взяты во время обычного контрольного исследования при поступлении в больницу, а образцы крови в контрольной группе были получены во время обычных периодических медицинских осмотров и сдачи крови. Здоровые испытуемые, входящие в контрольную группу, соответствовали по полу (учитывая, что 98% больных СР женского пола, в контрольную группу были отобраны женщины) и возрасту (основной возраст: 14,4 ± 8,2 лет) пациентов из основной группы. Все исследованные субъекты придерживались рациона питания, свойственного для средиземноморских стран. Исследование проводилось с одобрения Институтского наблюдательного совета, при этом было получено информированное согласие родителей или законных опекунов всех пациентов, включенных в исследование.
2.2. Дизайн исследования. Целью настоящего исследования являлась оценка воздействия на протеом плазмы добавочного введения ω-3 ПНЖК, эффективность которых уже была подтверждена в клинических условиях [21-23].Следовательно, по этическим причинам мы не включили группу плацебо и ограничились исследованием трех популяций субъектов: контрольная группа, состоящая из здоровых людей, группа пациентов с СР, не проходящих лечение, и группа пациентов с СР, дополнительно получавших ω-3 ПНЖК.
2.3. Дополнительное введение в рацион ω-3 ПНЖК.ω-3 ПНЖК вводились в виде рыбьего жира (производства компании «Norwegian Fish Oil AS», Тронхейм, Норвегия, номер продукта HO320-6; итальянский импортер: «Transforma AS Italia», Форли, Италия; регистрационный код Министерства Италии: 10 43863-Y) в дозе, соответствующей ДГК = 71,9 ± 13,9 мг/кг масса тела/день и ЭПК = 115,5 ± 22,4 мг/кг масса тела/день, с общим содержанием ω-3 ПНЖК 242,4 ± 47,1 мг/кг масса тела/день. Употребление ЭПК в сочетании с ДГК при СР было одобрено Этическим комитетом AOUS.
Доза, использованная в данной конкретной когорте девочек превышает стандартную норму в 5-6 раз, которая, как правило, составляет 2 г в день на взрослого человека. Ее обоснование приводилось в предыдущей работе [21], в которой нами была предложена очень высокая доза при синдроме Ретта. В результате нескольких попыток в клинических условиях была эмпирически определена окончательная доза в расчете кг/день.
2.4. Сбор образцов. Все образцы пациентов с СР и здоровых субъектов исследования были собраны натощак около восьми часов утра. Кровь собирали в гепаринизированные пробирки, и все манипуляции проводились в течение 2 часов после сбора образцов.
2.5. Подготовка образцов. Образцы крови были центрифугированы в количестве 2400 г в течение 15 мин при 4°C; обедненная тромбоцитами плазма была сохранена; лейкоцитарная пленка была удалена отсасыванием. До анализа образцы плазмы хранились при температуре -70°C.
2.6. Двумерный гель-электрофорез. Двумерный гель-электрофорез проводился в соответствии с публикацией Горга и др. [24], и образцы, содержащие 60 мкм белка, которое было определено согласно Брэдфорду [25], были денатурированы раствором, содержащим 10% додецилсульфата натрия (ДСН) и 2,3% дитиотреитола (ДТТ), нагретым до 95°C в течение 5 минут. Затем образец соединили с растворяющим буфером, состоящим из 8 М мочевины, 2% 3-[(3-холамидопропил) диметиламмоний]-1-пропансульфонатом (СНAPS), 0,3% ДТТ и 2% буфером с фиксированным градиентом pH (IPG), понесли на полоски геля длиной 18 см с pH 3–10, поместили в установку Ettan IPGphor (GE Healthcare) и регидратировали в течении 7 часов. Изоэлектрическое фокусирование (ИЭФ) проводилось при 32 кВт-ч. Вначале полоски были уравновешены в течение 15 минут с помощью буферного раствора, содержащего 50 мМ Трис-HCl, pH 8,8, 6 М мочевины, 2,5% (вес/об.) ДСН, 30% (об./об.) глицерина и 1% (вес/об.) ДТТ, после чего уравновешивание проводилось повторно описанным выше буферным раствором, в котором ДТТ был заменен 4% (вес/об.) иодоацетамидом.Электрофорез во втором направлении проводился с помощью электрофоретической системы Ettan Daltsix (GE Healthcare). Полоски IPG поместили на вертикальный полиакриламидный градиентный гель (8-16% T) толщиной 1,5 мм, залили 0,5% (вес/об.) арагозой и провели электрофорез при постоянном токе 40 мА/гель и температуре 20°C. Каждый образец был представлен в трех повторностях при идентичных условия.
2.7. Анализ изображений. Изображения были проанализированы с помощью компьютерной программы ImageMaster 2D Platinum v7.0 (GEHealthcare). Для каждой группы (т.е. контрольная группа, группа пациентов с СР, не получавших ω-3 ПНЖК, и группа пациентов с СР после получения ω-3 ПНЖК) был определен эталонный гель, который использовался для сравнительного анализа. Фон был выведен на основании всех используемых гелей путем определения среднего значения в пограничном слое. Объем пятна выражался в виде отношения к общему процентному объему белка (%V), определенному во всем геле, чтобы минимизировать разницы между гелями (нормализация геля) для их объединения. С эталонным гелем сопоставлялись только те пятна, которые были определены во всех гелях одной и той же группы.
2.8. Идентификация белков. После окрашивания серебром, совместимого с масс-спектрометрией, составили и экспортировали в Ettan Spot Picker (GE Healthcare) список для выбора пятен. Пятна вырезали и поместили в 96-ячеечные микропланшеты, в которых их обесцветили и удалили остатки воды с помощью ацетонитрила (АЦН) для последующей регидратации с раствором трипсина.Обработка трипсином проводилась в течение ночи при температуре 37° C. Каждое пропитанное трипсином протеиновое пятно (0,75 мл) наносили на мишень МАЛДИ и давали высохнуть. После этого высушенные образцы обрабатывали 0,75 мл матричного раствора (α-циано-4- гидроксикоричная кислота в 50% АЦН и 0,5% о/о трифторуксусной кислоты) и повторно высушивали.Масс-спектры были получены согласно [27] с помощью системы ultrafleXtreme MALDI-ToF/ToF (Bruker Corporation, Биллерика, Массачусетс, США). После получения массы триптического пептида проводился поиск отпечатка массы по совпадению в базах данных Swiss-Prot/TREMBL и NCBInr с помощью MASCOT (Matrix Science, Лондон, Великобритания, http://www.matrixscience.com/).
2.9. Анализ данных. Все переменные были протестированы на нормальное распределение (тест Д'Агостино-Пирсона), данные были представлены в виде средних значений и вероятных отклонений. Статистический анализ белка с дифференциальной экспрессией был выполнен с помощью теста Стьюдентса и однофакторного дисперсионного анализа (ANOVA). Для множественных тестов использовались поправки Бонферрони. Пятна, не имеющие совпадений, и пятна с существенным отличием в проценте объема считались «дифференциальной экспрессией» в данной группе. Сравнения между белками с дифференциальной экспрессией в группе пациентов с СР, не получавшими лечение, и в группе пациентов с СР, принимавшими ω-3 ПНЖК, оценивались с помощью критерия суммы рангов Манна-Уитни или критерия Крускала-Уоллиса. Результаты незначительных размеров популяции на возможную погрешность тип I (a)/тип II при интерпретации данных были рассмотрены с помощью алгоритма объема выборки. Считалось, что двусторонний критерий значимости P < 0,05 указывает на статистическую значимость. При этом использовался пакет статистического программного обеспечения MedCalc версия 12.1.4 (MedCalc Software, Мариакерк, Бельгия).
3. Результаты
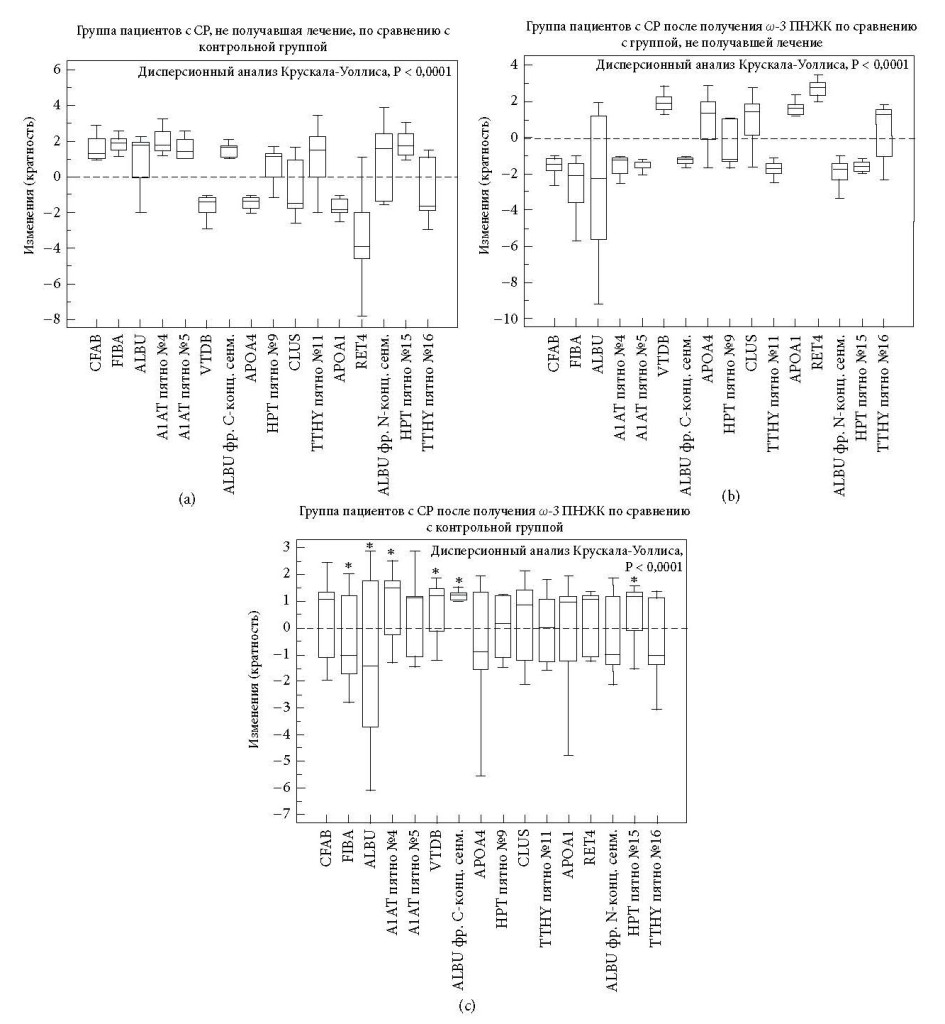
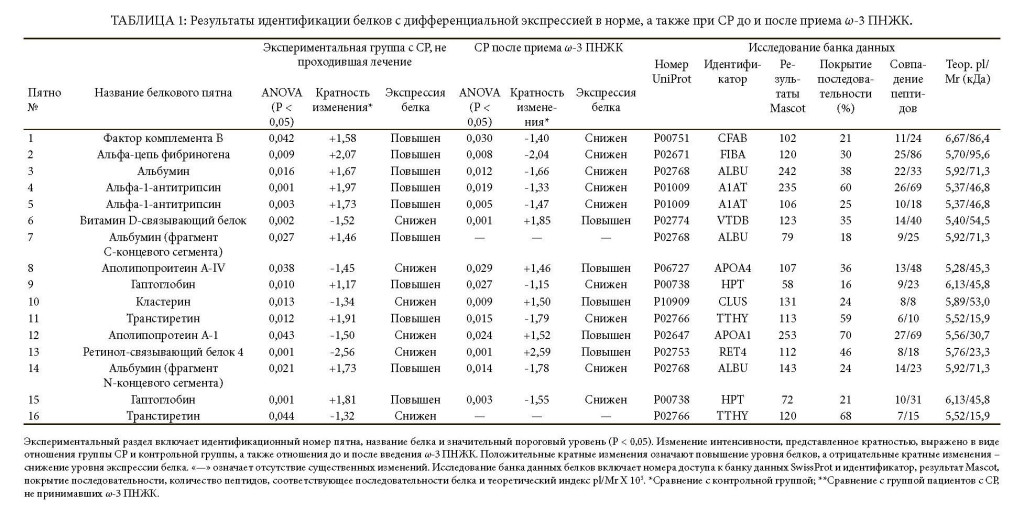
Было обнаружено, что экспрессия 16 белков, связанных в основном с ОФО, у пациентов, не проходивших лечение, была изменена на этапе включения.
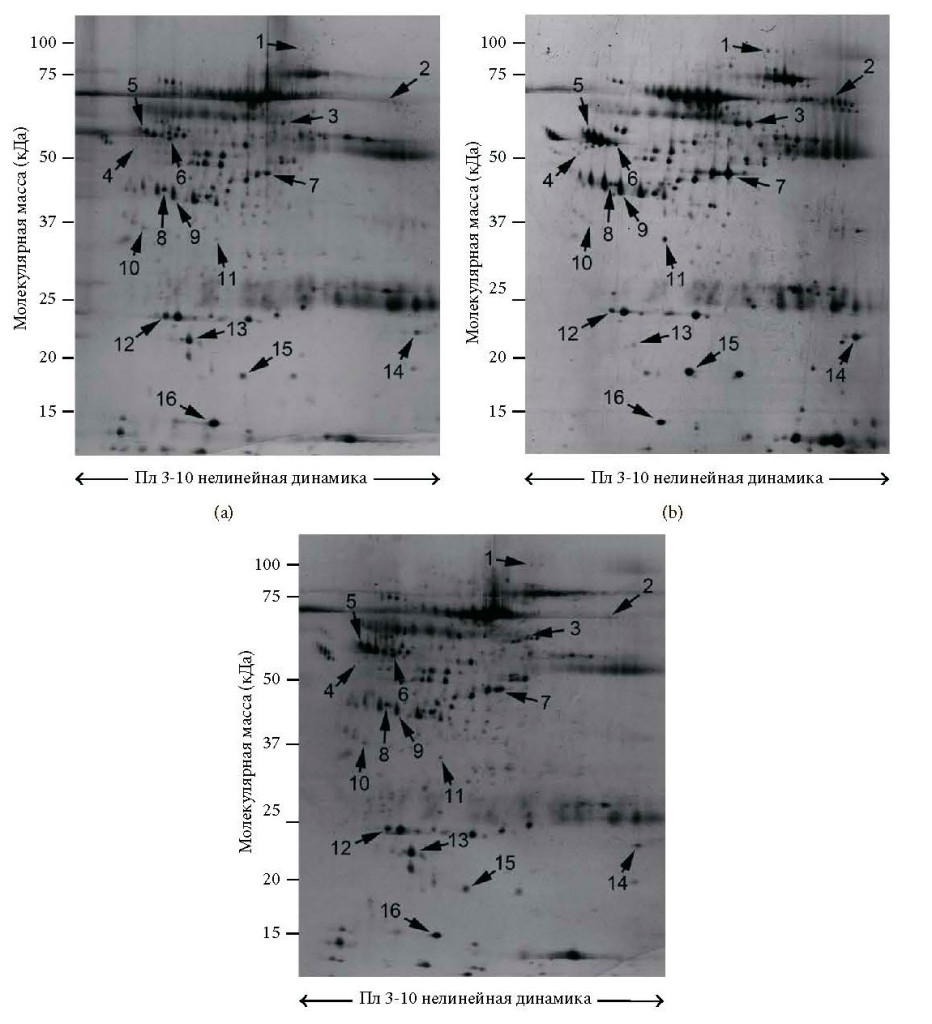
По сравнению со здоровыми субъектами во всей группе пациентов с СР наблюдалось значительное увеличение 10 белковых пятен [т.е. фактор комплемента B (CFAB), альфа-цепь фибриногена (FIBA), сывороточный альбумин (ALBU, пятно №3, фрагмент C-концевого сегмента №7 и фрагмент N-концевого сегмента №14) альфа-1-анти- трипсин (A1AT, пятна №4 и №5), гаптоглобин (HPT, пятна №9 и №15) и транстиретин (TTHY пятно №11)], а также сокращение 6 белковых пятен [т.е. витамин D-связывающий белок (VTDB), аполипопротеин A4 (APOA4), кластерин (CLUS), аполипопротеин A1 (APOA1), ретинол-связывающий белок 4 (RET4) и транстиретин (TTHY пятно №16)] (Таблица 1 и Рисунки 1(a), 1(b) и 2(a)). Полный список известных биологических функций для идентифицированных белков плазмы представлен в Таблице 2.
После дополнительного введения в рацион ω-3 ПНЖК экспрессия 10 из 16 (62%) белков, как обнаружилось, стала сопоставима с контрольной группой (Рисунок 2(c)). В частности, после приема ω-3 ПНЖК уровни экспрессии белков плазмы были сравнимы с контрольной популяцией, за исключением постоянной избыточной экспрессии A1AT (пятно №4), VTDB (пятно №6), фрагмент C-концевого сегмента ALBU (пятно №7) и HPT (пятно №15), а также постоянной недостаточной экспрессии FIBA (пятно №2) и ALBU (пятно №3).
Сравнивая профиль белков плазмы в группе пациентов с СР, принимавших ω-3 ПНЖК, с профилем белков до лечения, было отмечено существенное сокращение 9 белковых пятен, которые до лечения имели избыточную экспрессию, включая CFAB, FIBA, ALBU (пятна №3 и №14), A1AT, HPT и TTHY (пятно №11), в то же время наблюдалось существенное увеличение 5 белковых пятен, которые до приема ω-3 ПНЖК имели недостаточную экспрессию: VTDB, APOA4, CLUS, APOA1 и RET4. После дополнительного введения в рацион ω-3 ПНЖК уровни ALBU (пятно №7) и ALBU (пятно №16) остались неизменны по сравнению с группой пациентов в СР, которые не проходили лечение (Таблица 1 и Рисунки 1(a), 1(c) и 2(b)).
4. Обсуждение
Механизм действия ω-3 ПНЖК является одним из основных областей исследования, которое в течение последних двух десятилетий привело к открытию протектинов, резолвинов и марезинов, а также всех липидных медиаторов, участвующих в активном разрешении воспалительного процесса [28].
Полученные нами результаты показывают, что ω-3 ПНЖК могут модулировать экспрессию белков плазмы при СР, оказывая значительное влияние на модуляцию ОФО с частичным устранением (приблизительно 62%) белковых изменений, наблюдаемых на исходном уровне.
Список литературы- Amir RE, Van den Veyver IB, Wan M, Tran CQ, Francke U, Zoghbi HY (1999) Rett syndrome is caused by mutations in X-linked MECP2, encoding methyl-CpG-binding protein 2. Nat Genet 23:185–188
- Anderson BM, Ma DWL (2009) Are all n-3 polyunsaturated fatty acids created equal? Lipids Health Dis 8:33
- Ariani F, Hayek G, Rondinella D, Artuso R, Mencarelli MA, Spanhol-Rosseto A, Pollazzon M, Buoni S, Spiga O, Ricciardi S, Meloni I, Longo I, Mari F, Broccoli V, Zappella M, Renieri A (2008) FOXG1 is responsible for the congenital variant of Rett syndrome. Am J Hum Genet 83:89–93
- Arnold C, Markovic M, Blossey K, Wallukat G, Fischer R, Dechend R, Konkel A, von Schacky C, Luft FC, Muller DN, Rothe M, Schunck WH (2010) Arachidonic acid-metabolizing cytochrome P450 enzymes are targets of 3 fatty acids. J Biol Chem 285:32720–32733
- Ballas N, Lioy DT, Grunseich C, Mandel G (2009) Non-cell autonomous influence of MeCP2-deficient glia on neuronal dendritic morphology. Nat Neurosci 12:311–317
- Bazan NG (2007) Omega-3 fatty acids, pro-inflammatory signaling and neuroprotection. Curr Opin Clin Nutr Metab Care 10:136–141
- Belayev L, Marcheselli VL, Khoutorova L, Rodriguez de Turco EB, Busto R, Ginsberg MD, Bazan NG (2005) Docosahexaenoic acid complexed to albumin elicits high-grade ischemic neuroprotec- tion. Stroke 36:118–123
- Belayev L, Khoutorova L, Atkins KD, Bazan NG (2009) Robust docosahexaenoic acid-mediated neuroprotection in a rat model of transient, focal cerebral ischemia. Stroke 40:3121–3126
- Ben-Shachar S, Chahrour M, Thaller C, Shaw CA, Zoghbi HY (2009) Mouse models of MeCP2 disorders share gene expression changes in the cerebellum and hypothalamus. Hum Mol Genet 18:2431–2442
- Calder PC (2006) n-3 polyunsaturated fatty acids, inflammation, and inflammatory diseases. Am J Clin Nutr 83:1505S–1519S
- Calder PC, Yaqoob P (2009) Understanding omega-3 polyunsaturated fatty acids. Postgrad Med 121:148–157
- Cappa M, Bizzarri C, Vollono C, Petroni A, Banni S (2011) Adrenoleukodystrophy. Endocr Dev 20:149–160
- Chahrour M, Zoghbi HY (2007) The story of Rett syndrome: from clinic to neurobiology. Neuron 56:422–437
- Chahrour M, Jung SY, Shaw C, Zhou X, Wong ST, Qin J, Zoghbi HY (2008) MeCP2, a key contributor to neurological disease, activates and represses transcription. Science 320:1224–1229
- Chang CY, Ke DS, Chen JY (2009) Essential fatty acids and human brain. Acta Neurol Taiwan 18:231–241
- Chao HT, Chen H, Samaco RC, Xue M, Chahrour M, Yoo J, Neul JL, Gong S, Lu HC, Heintz N, Ekker M, Rubenstein JL, Noebels JL, Rosenmund C, Zoghbi HY (2010) Dysfunction in GABA signalling mediates autism-like stereotypies and Rett syndrome phenotypes. Nature 468:263–269
- Chapkin RS, McMurray DN, Davidso LA, Patil BS, Fan YY, Lupton JR (2008) Bioactive dietary long-chain fatty acids: emerging mechanisms of action. Br J Nutr 100:1152–1157
- Chen J, Chua KW, Chua CC, Yu H, Pei A, Chua BH, Hamdy RC, Xu X, Liu CF (2011) Antioxidant activity of 7,8-dihydroxyflavone provides neuroprotection against glutamate-induced toxicity. Neurosci Lett 499:181–185
- Cobb S, Guy J, Bird A (2010) Reversibility of functional deficits in experimental models of Rett syndrome. Biochem Soc Trans 38:498–506
- Collins AL, Levenson JM, Vilaythong AP, Richman R, Armstrong DL, Noebels JL, David Sweatt J, Zoghbi HY (2004) Mild overexpression of MeCP2 causes a progressive neurological disorder in mice. Hum Mol Genet 13:2679–2689
- Comporti M, Signorini C, Buonocore G, Ciccoli L (2002) Iron release, oxidative stress and erythrocyte ageing. Free Radic Biol Med 32:568–576
- Comporti M, Signorini C, Arezzini B, Vecchio D, Monaco B, Gardi C (2008) F2-isoprostanes are not just markers of oxidative stress.
- Free Radic Biol Med 44:247–256 de Assis AM, Rech A, Longoni A, Rotta LN, Denardin CC, Pasquali MA, Souza DO, Perry ML, Moreira JC (2012) X3-Polyunsat- urated fatty acids prevent lipoperoxidation, modulate antioxidant enzymes, and reduce lipid content but do not alter glycogen metabolism in the livers of diabetic rats fed on a high fat thermolyzed diet. Mol Cell Biochem 361:151–160
- De Felice C, Ciccoli L, Leoncini S, Signorini C, Rossi M, Vannuccini L, Guazzi G, Latini G, Comporti M, Valacchi G, Hayek J (2009) Systemic oxidative stress in classic Rett syndrome. Free Radic Biol Med 47:440–448
- De Felice C, Signorini C, Durand T, Oger C, Guy A, Bultel-Ponce´ V, Galano JM, Ciccoli L, Leoncini S, D’Esposito M, Filosa S, Pecorelli A, Valacchi G, Hayek J (2011) F2-dihomo-isopros- tanes as potential early biomarkers of lipid oxidative damage in Rett syndrome. J Lipid Res 52:2287–2297
- Deckelbaum RJ, Worgall TS, Seo T (2006) n-3 fatty acids and gene expression. Am J Clin Nutr 83:1520S–1525S
- El-Ansary AK, Al-Daihan SK, El-Gezeery AR (2011) On the protective effect of omega-3 against propionic acid-induced neurotoxicity in rat pups. Lipids Health Dis 10:142
- Fourcade S, Lo´ pez-Erauskin J, Galino J, Duval C, Naudi A, Jove M, Kemp S, Villarroya F, Ferrer I, Pamplona R, Portero-Otin M, Pujol A (2008) Early oxidative damage underlying neurodegen- eration in X- adrenoleukodystrophy. Hum Mol Genet 17:1762–1773
- Galino J, Ruiz M, Fourcade S, Schlu¨ter A, Lo´pez-Erauskin J, Guilera C, Jove M, Naudi A, Garc´ıa-Arum´ı E, Andreu AL, Starkov AA, Pamplona R, Ferrer I, Portero-Otin M, Pujol A (2011) Oxidative damage compromises energy metabolism in the axonal degen- eration mouse model of X-adrenoleukodystrophy. Antioxid Redox Signal 15:2095–2107
- Gamoh S, Hashimoto M, Sugioka K, Shahdat Hossain M, Hata N, Misawa Y, Masumura S (1999) Chronic administration of docosahexaenoic acid improves reference memory-related learn- ing ability in young rats. Neuroscience 93:237–241
- Guy J, Gan J, Selfridge J, Cobb S, Bird A (2007) Reversal of neurological defects in a mouse model of Rett syndrome. Science 315:1143–1147
- Guy J, Cheval H, Selfridge J, Bird A (2011) The role of MeCP2 in the brain. Annu Rev Cell Dev Biol 27:631–652
- Hagberg B, Aicardi J, Dias K, Ramos O (1983) A progressive syndrome of autism, dementia, ataxia, and loss of purposeful hand use in girls: Rett’s syndrome: report of 35 cases. Ann Neurol 14:471–479
- Halliwell B, Gutteridge J (1999) Free radicals, other reactive species and disease. In: Halliwell B, Gutteridge J (eds) Free radicals in biology and medicine. Clarendon Press, Oxford, pp 617–783
- Johnson RA, Lam M, Punzo AM, Li H, Lin BR, Ye K, Mitchell GS, Chang Q (2011) 7,8-dihydroxyflavone (7,8-DHF) exhibits ther- apeutic efficacy in a mouse model of Rett syndrome. J Appl Physiol. doi:10.1152/japplphysiol.01361
- Jump DB (2002) The biochemistry of n-3 polyunsaturated fatty acids.
- J Biol Chem 277:8755–8758
- Kadiiska MB, Gladen BC, Baird DD, Germolec D, Graham LB, Parker CE, Nyska A, Wachsman JT, Ames BN, Basu S, Brot N, Fitzgerald GA, Floyd RA, George M, Heinecke JW, Hatch GE, Hensley K, Lawson JA, Marnett LJ, Morrow JD, Murray DM, Plastaras J, Roberts LJ, Rokach J, Shigenaga MK, Sohal RS, Sun J, Tice RR, Van Thiel DH, Wellner D, Walter PB, Tomer KB, Mason RP, Barrett JC (2005) Biomarkers of oxidative stress study II: are oxidation products of lipids, proteins, and DNA markers of CCl4 poisoning? Free Radic Biol Med 38:698–710 Kawashima H, Nishimata S, Ishii C, Yamanaka G, Kashiwagi Y,
- Takekuma K, Hoshika A, Watanabe Y (2011) New treatment of free-radical scavenger in adrenoleukodystrophy. J Clin Pharm Ther 36:412–415
- Kris-Etherton PM, Harris WS, Appel LJ; American Heart Associa- tion. Nutrition Committee (2002) Fish consumption, fish oil, omega-3 fatty acids, and cardiovascular disease. Circulation 106:2747–2757
- Kron M, Mu¨ller M (2010) Impaired hippocampal Ca2? homeostasis and concomitant K? channel dysfunction in a mouse model of
- Rett syndrome during anoxia. Neuroscience 171:300–315 Leoncini S, De Felice C, Signorini C, Pecorelli A, Durand T, Valacchi
- G, Ciccoli L, Hayek J (2011) Oxidative stress in Rett syndrome: natural history, genotype, and variants. Redox Rep 16:145–153
- Lien EL (2009) Toxicology and safety of DHA. Prostaglandins Leukot Essent Fatty Acids 81:125–132
- Lo´ pez-Erauskin J, Fourcade S, Galino J, Ruiz M, Schlu¨ter A, Naudi
- A, Jove M, Portero-Otin M, Pamplona R, Ferrer I, Pujol A (2011) Antioxidants halt axonal degeneration in a mouse model of X-adrenoleukodystrophy. Ann Neurol 70:84–92
- Macdonald JL, Verster A, Berndt A, Roskams AJ (2010) MBD2 and MeCP2 regulate distinct transitions in the stage-specific differ- entiation of olfactory receptor neurons. Mol Cell Neurosci 44:55–67
- Maezawa I, Swanberg S, Harvey D, LaSalle JM, Jin LW (2009) Rett syndrome astrocytes are abnormal and spread MeCP2 deficiency through gap junctions. J Neurosci 29:5051–5061
- Mahmood A, Bibat G, Zhan AL, Izbudak I, Farage L, Horska A, Mori S, Naidu S (2010) White matter impairment in Rett syndrome: diffusion tensor imaging study with clinical correlations. AJNR Am J Neuroradiol 31:295–299
- Marchetto MC, Carromeu C, Acab A, Yu D, Yeo GW, Mu Y, Chen G, Gage FH, Muotri AR (2010) A model for neural development and treatment of Rett syndrome using human induced pluripotent stem cells. Cell 143:527–539
- Mari F, Azimonti S, Bertani I, Bolognese F, Colombo E, Caselli R, Scala E, Longo I, Grosso S, Pescucci C, Ariani F, Hayek G, Balestri P, Bergo A, Badaracco G, Zappella M, Broccoli V, Renieri A, Kilstrup-Nielsen C, Landsberger N (2005) CDKL5 belongs to the same molecular pathway of MeCP2 and it is responsible for the early-onset seizure variant of Rett syndrome. Hum Mol Genet 14:1935–1946
- Mas E, Woodman RJ, Burke V, Puddey IB, Beilin LJ, Durand T, Mori TA (2010) The omega-3 fatty acids EPA and DHA decrease plasma F(2)-isoprostanes: Results from two placebo-controlled interventions. Free Radic Res 44:983–990
- Mastroeni R, Bensadoun JC, Charvin D, Aebischer P, Pujol A, Raoul C (2009) Insulin-like growth factor-1 and neurotrophin-3 gene therapy prevents motor decline in an X-linked adrenoleukodys- trophy mouse model. Ann Neurol 66:117–122
- Matarazzo MR, De Bonis ML, Vacca M, Della Ragione F, D’Esposito M (2009) Lessons from two human chromatin diseases, ICF syndrome and Rett syndrome. Int J Biochem Cell Biol 41:117–126
- McGahon BM, Martin DS, Horrobin DF, Lynch MA (1999) Age- related changes in synaptic function: analysis of the effect of dietary supplementation with omega-3 fatty acids. Neuroscience 94:305–314
- McNamara RK (2010) DHA deficiency and prefrontal cortex neuropathology in recurrent affective disorders. J Nutr 140:864–868
- Montine KS, Quinn JF, Zhang J, Fessel JP, Roberts LJ 2nd, Morrow JD, Montine TJ (2004) Isoprostanes and related products of lipid peroxidation in neurodegenerative diseases. Chem Phys Lipids 128:117–124
- Montuschi P, Barnes PJ, Roberts LJ (2004) Isoprostanes: markers and mediators of oxidative stress. FASEB J 18:1791–1800
- Morrow JD, Roberts LJ (1997) The isoprostanes: unique bioactive products of lipid peroxidation. Prog Lipid Res 36:1–21
- Morrow JD, Hill KE, Burk RF, Nammour TM, Badr KF, Roberts LJ (1990) A series of prostaglandin F2-like compounds are produced in vivo in humans by a non-cyclooxygenase, free radical-catalyzed mechanism. Proc Natl Acad Sci USA 87:9383–9387
- Naidu S, Johnston MV (2011) Neurodevelopmental disorders: clinical criteria for Rett syndrome. Nat Rev Neurol 7:312–314
- Neul JL, Fang P, Barrish J, Lane J, Caeg EB, Smith EO, Zoghbi H, Percy A, Glaze DG (2008) Specific mutations in methyl-CpG- binding protein 2 confer different severity in Rett syndrome. Neurology 70:1313–1321
- Neul JL, Kaufmann WE, Glaze DG, Christodoulou J, Clarke AJ, Bahi- Buisson N, Leonard H, Bailey ME, Schanen NC, Zappella M, Renieri A, Huppke P, Percy AK (2010) Rett syndrome: revised diagnostic criteria and nomenclature. Ann Neurol 68:944–950
- Nourooz-Zadeh J (2008) Key issues in F2-isoprostane analysis.
- Biochem Soc Trans 36:1060–1065
- Nourooz-Zadeh J, Gopaul NK, Barrow S, Mallet AI, Anggard EE (1995) Analysis of F2-isoprostanes as indicators of non- enzymatic lipid peroxidation in vivo by gas chromatography- mass spectrometry: development of a solid-phase extraction procedure. J Chromatogr B Biomed Appl 667:199–208
- Ogier M, Wang H, Hong E, Wang Q, Greenberg ME, Katz DM (2007) Brain-derived neurotrophic factor expression and respi- ratory function improve after ampakine treatment in a mouse model of Rett syndrome. J Neurosci 27:10912–10917
- Pecorelli A, Ciccoli L, Signorini C, Leoncini S, Giardini A, D’Esposito M, Filosa S, Hayek J, De Felice C, Valacchi G (2011) Increased levels of 4HNE-protein plasma adducts in Rett syndrome. Clin Biochem 44:368–371
- Rett A (1966) On a unusual brain atrophy syndrome in hyperammo- nemia in childhood. Wien Med Wochenschr 116:723–726
- Roberts LJ, Montine TJ, Markesbery WR, Tapper AR, Hardy P, Chemtob S, Dettbarn WD, Morrow JD (1998) Formation of isoprostane-like compounds (neuroprostanes) in vivo from docosahexaenoic acid. J Biol Chem 273:13605–13612
- Roux JC, Dura E, Moncla A, Mancini J, Villard L (2007) Treatment with desipramine improbe breathing and survival in a mouse model for Rett syndrome. Eur J Neurosci 25:1915–1922
- Sastry PS (1985) Lipids of nervous tissue: composition and metab- olism. Prog Lipid Res 24:69–176
- Schmitz G, Ecker J (2008) The opposing effects of n-3 and n-6 fatty acids. Prog Lipid Res 47:147–155
- Serhan CN, Gotlinger K, Hong S, Lu Y, Siegelman J, Baer T, Yang R, Colgan SP, Petasis NA (2006) Anti-inflammatory actions of neuroprotectin D1/protectin D1 and its natural stereoisomers: assignments of dihydroxy-containing docosatrienes. J Immunol 176:1848–1859
- Serhan CN, Chiang N, Van Dyke TE (2008) Resolving inflammation: dual anti-inflammatory and pro-resolution lipid mediators. Nat Rev Immunol 8:349–361
- Signorini C, Comporti M, Giorgi G (2003) Ion trap tandem mass spectrometric determination of F2-isoprostanes. J Mass Spec- trom 38:1067–1074
- Signorini C, Ciccoli L, Leoncini S, Carloni S, Perrone S, Comporti M, Balduini W, Buonocore G (2009) Free iron, total F2-isoprostanes and total F4-neuroprostanes in a model of neonatal hypoxic- ischemic encephalopathy: neuroprotective effect of melatonin. J Pineal Res 46:148–154
- Signorini C, De Felice C, Leoncini S, Giardini A, D’Esposito M, Filosa S, Della Ragione F, Rossi M, Pecorelli A, Valacchi G, Ciccoli L, Hayek J (2011) F4-neuroprostanes mediate neurolog- ical severity in Rett syndrome. Clin Chim Acta 412:1399–1406
- Soderberg M, Edlund C, Kristensson K, Dallner G (1991) Fatty acid composition of brain phospholipids in aging and in Alzheimer’s disease. Lipids 26:421–425
Главный редактор — Т. Ю. Ходанович. Тел: +7 (495) 120-44-34, email: hello@pharmedu.ru
Публикация № P-31895