Cовременные аспекты патогенетической терапии остеоартроза
В статье подробно рассматриваются факторы риска, механизмы патогенеза и прогрессирования остеоартроза. Обсуждается роль хондропротекторов в комплексной терапии заболевания, приведены данные исследований по изучению эффективности глюкозамин сульфата и хондроитин сульфата, подтверждающие целесообразность их применения при остеоартрозе.
Остеоартроз (ОА) лидирует по распространенности среди других ревматических болезней. В последние годы наблюдается отчетливая тенденция к увеличению частоты ОА в популяции, что во многом связано с увеличением продолжительности жизни населения. Остеоартроз рассматривается как хроническое прогрессирующее заболевание синовиальных суставов с поражением прежде всего гиалинового хряща и субхондральной кости в результате сложного комплекса биомеханических, биохимических и/или генетических факторов (В.В. Бадокин). В основе этого полиэтиологического заболевания лежит нарушение равновесия между анаболическими и катаболическими процессами в тканях сустава, прежде всего в гиалиновом хряще, который представляет собой основной плацдарм патологических изменений. Истинную распространенность ОА трудно оценить, поскольку клиническая симптоматика далеко не всегда коррелирует с данными рентгенографии суставов, магнитно-резонансной томографии, ультразвуковых методов, а также с макро- и микроскопическими показателями, полученными при артроскопии или биопсии синовиальной оболочки. Хорошо известно, что многие рентгенопозитивные больные не имеют клинических симптомов ОА и, напротив, при выраженной клинической картине этого заболевания может наблюдаться рентгенонегативность. При ОА прежде всего поражаются нагрузочные (коленные и тазобедренные) суставы, что значительно ухудшает качество жизни больных и представляет серьезную социально-экономическую проблему [1]. ОА не влияет непосредственно на жизненный прогноз, но является одной из основных причин преждевременной потери трудоспособности и инвалидности, уступая в этом отношении только ишемической болезни сердца. В отчете ВОЗ о социальных последствиях заболеваний опорно-двигательного аппарата указывается, что ОА коленных суставов занимает 4-е место среди причин нетрудоспособности у женщин и 8-е у мужчин [2]. Значение ОА в клинической практике определяется в т. ч. и коморбидной патологией, которая наблюдается при этом заболевании [3, 4]. Имеются убедительные доказательства, что распространенность многих коморбидных состояний, включая метаболический синдром, ожирение и сердечно-сосудистые заболевания, при ОА выше, чем в популяции. Артериальная гипертензия наблюдается примерно у 40% больных с ОА и только у 25% больных того же пола и возраста, но без ОА, а сахарный диабет – у 11% и 6% соответственно. Распространенность некоторых других коморбидных состояний также существенно выше при ОА по сравнению с общей популяцией, включая гиперхолестеринемию (32 и 24%), повышение содержания холестерина липопротеидов низкой плотности (13 и 12%), почечные дисфункции (37 и 27%). Определение факторов риска развития и прогрессирования ОА имеет прямое отношение к первичной и вторичной его профилактике. Эти факторы подразделяются на модифицированные, которые могут быть подвергнуты коррекции, и немодифицированные, активно воздействовать на которые невозможно. Наибольшее значение среди немодифицированных факторов имеют пол, возраст больных, врожденные нарушения (гипермобильность, дисплазия, нестабильность) и генетические факторы, такие как патология гена коллагена II типа, семейная агрегация ОА [5]. Генетические ассоциации при ОА пока что трудно интерпретировать, но все же идиопатический ОА можно рассматривать с позиций полигенного и гетерогенного заболевания с различными фенотипами. При генерализованном ОА выявлен полиморфизм гена II типа коллагена (COL2A1), локализующегося на 12-й хромосоме, а также гены полиморфизма интерлейкина 1 (ИЛ-1) и ИЛ-1RA, определяющие высокий уровень секреции ИЛ-1 и низкий ИЛ-1RA. Эти данные, хотя и косвенно, иллюстрируют значение ИЛ-1 в патофизиологии ОА. Патогенетические механизмы развития остеоартроза Основным патологическим стигматом ОА является дегенерация суставного (гиалинового) хряща с уменьшением его объема. В патологический процесс вовлекаются и другие ткани сустава. Нередко наблюдаются рецидивирующий синовит с припухлостью сустава и повышением локальной температуры, а также воспалительным ритмом боли, хотя возможна и стертая клиническая его картина, а также тендиниты, тендовагиниты и энтезиты, проявляющиеся, например, синдромом «гусиной лапки». Большое значение имеет костное ремодулирование, которое сопровождается формированием остеофитов и склерозом субхондральной кости. Кроме того, при ОА имеет место периартикулярная мышечная атрофия, дегенерация менисков, фиброз капсулы сустава и изменения в нейросенсорной системе. Патогенез первичного ОА во многом расшифрован. В развитии и прогрессировании этого заболевания принимают участие несколько факторов, включая иммунологические, биохимические и генетические [5]. Немаловажное значение придается механическому стрессу, который приводит к активации интегрин-рецептора (механорецептора), экспрессии митоген-активированного белка – киназы (MAPK) и ядерного фактора kappa B (NF-KB), а также металлопротеиназ и провоспалительных цитокинов. При этом заболевании наблюдается диссонанс между механической нагрузкой и неспособностью тканей сустава адекватно противостоять механической нагрузке из-за ограничения репаративных возможностей хряща. Механический стресс воздействует на гиалиновый хрящ посредством механорецепторов, расположенных на хондроцитах (рис. 1). Обязательным атрибутом ОА является дегенерация суставного (гиалинового) хряща, в основе которой лежит недостаточный синтез хондроцитами протеогликанов и фрагментация протеогликановых агрегатов. Патологические изменения при этом заболевании также включают костный венозный стаз и внутримедуллярную гипертензию, трабекулярные микропереломы, субхондральный остеосклероз и образование остеофитов, формирование кист в периартикулярной кости и нестабильность суставов. Однако основным проявлением является истончение и разволокнение суставного хряща, в реализации которого участвуют как клеточные факторы, так и растворимые медиаторы [5]. К клеточным факторам относятся хондроциты гиалинового хряща, остеоциты и остеобласты субхондральной кости, синовиоциты и мононуклеарные клетки синовиальной оболочки. Растворимые медиаторы вырабатываются хондроцитами, а также синовиоцитами и инфильтрирующими мононуклеарными клетками. К ним относятся провоспалительные цитокины, протеиназы, оксид азота и липидные медиаторы (лептин, адипонектин, вистатин, резистин). Адипокины являются новым классом растворимых медиаторов, которые участвуют в деградации хряща. Субхондральные остеобласты также способны продуцировать растворимые медиаторы, такие как инсулиновый фактор роста 1 (IGF-1), трансформирующий фактор роста − бета (TGF-β), ИЛ-6, липидные медиаторы, протеиназы, фрагменты фибронектина и нейропептиды.
Хотя ОА считается основным дегенеративным заболеванием суставов, в последнее время появляются убедительные данные, позволяющие рассматривать его как нозологическую форму, в патогенезе которой важнейшую роль играет персистирующее воспаление в тканях сустава [6, 7]. Такое воспаление cпособствует прогрессированию морфологических изменений, в т. ч. структурных изменений гиалинового хряща с его дегенерацией и уменьшением объема. Интересно, что на Европейском конгрессе ревматологов в 2012 г. обсуждалась целесообразность назначения больным ОА низких доз преднизолона, метотрексата и ингибиторов ФНО-α.
В настоящее время получены веские доказательства, подтверждающие влияние провоспалительных медиаторов на метаболизм клеток гиалинового хряща и течение ОА [8]. Среди медиаторов, ответственных за прогрессирование этого заболевания, ключевое значение имеет IL-1β, который экспрессируется в пораженном ОА хряще и стимулирует выработку металлопротеиназ (ММП) (рис. 2). В реализации деструкции хряща при первичном ОА решающее значение имеет гиперпродукция хондроцитами и другими клетками ММП, включая коллагеназы (ММП-1, 8, 13), аггреканазы (ADAM-TS4 и TS5), стромелизина-1 (ММР-3) и желатиназы (ММР-2, 9). IL-1β тормозит экспрессию ингибиторов ММП, синтез коллагена и протеогликанов, экспрессирует активатор плазминогена и в то же время стимулирует синтез и высвобождение некоторых эйкозаноидов, в т. ч. простагландинов и лейкотриенов [7]. Он стимулирует продукцию других провоспалительных цитокинов (IL-6, IL-8) и определяет уровень катаболического процесса при ОА.
В развитии ОА участвуют и другие члены суперсемейства IL-1, фактор некроза опухоли-α (TNF-α), IL-6, IL-17, IL-18, онкостатин М (OSM), фактор ингибиции лейкемии (LIF). Cодержание TNF-α существенно ниже при ОА, чем при ревматоидном артрите, но при тяжелом течении ОА его значения достоверно выше, чем у здоровых лиц. Существенную роль в развитии воспаления у больных ОА отводят онкостатину М (цитокин семейства IL-6). В эксперименте показано, что он способствует высвобождению из гиалинового хряща протеогликанов, стромелизина-1 и коллагена. ОSM усиливает активность других провоспалительных медиаторов, включая IL-6. В свою очередь, IL-6 индуцирует синтез тканевых ингибиторов матриксных ММП, IL-1Ra и растворимого рецептора TNF. Роль IL-18 в патогенезе ОА подтверждается наличием его в биоптатах гиалинового хряща и синовиальной оболочки, полученных от больных ОА.
В патогенезе ОА принимают участие также ряд других медиаторов воспаления. При остеоартрозе в гиалиновом хряще повышается продукция оксида азота, который определяется в синовиальной жидкости и сыворотке крови. Хорошо известна биологическая активность простагландинов. Наиболее изученный PGE2 способствует повреждению тканей сустава путем потенцирования ММП и других медиаторов воспаления. Он тормозит репарацию поврежденного хряща и индуцирует его фибропластическую дегенерацию, стимулирует остеокластическую костную резорбцию и ангиогенез. Однако только ингибиция PGE2 не замедляет прогрессирование ОА. Известно, что синтез PGE2 является лишь одной из составных частей метаболизма арахидоновой кислоты, из которой образуются и многие другие медиаторы, в частности лейкотриены. Лейкотриены также участвуют в персистенции воспалительного процесса независимо от простагландинов. Лейкотриены, например LTB4 или LTC4, потенцируют хемотаксис воспалительных факторов и стимулируют высвобождение провоспалительных цитокинов, таких как IL-1β и TNF-α. В каскаде воспалительных медиаторов, играющих значительную роль в развитии структурных изменений при ОА, принимают участие протеазоактивированные рецепторы (PARs), прежде всего PAR-2.
Медикаментозная терапия остеоартроза
Эффективная терапия данного заболевания представляет сложную задачу, что связано с хроническим и неуклонно прогрессирующим течением этого заболевания, подчас без каких-либо видимых предрасполагающих факторов. Лечение должно быть направлено на профилактику прогрессирования заболевания и предупреждение серьезных структурных изменений в тканях сустава. Выполнение этой задачи требует проведения комплексной и длительной, практически постоянной терапии с включением немедикаментозных и медикаментозных методов, воздействующих на главные звенья патогенеза ОА. При планировании рациональной терапии следует иметь в виду коморбидные заболевания, которые нередко наблюдаются при ОА и существенно влияют на его прогноз.
Основные направления лечения остеоатроза:
§ устранение внешних причин, способствующих его развитию и прогрессированию;
§ воздействие на проявления реактивного артрита и воспаления в других тканях сустава, что предусматривает проведение антивоспалительной терапии;
§ нормализация или позитивное влияние на нарушенный метаболизм суставного хряща, что обеспечивает симптоматическая медленнодействующая (хондроактивная, хондропротективная) терапия;
§ восстановление функции пораженных суставов с использованием большого спектра реабилитационных мероприятий, включая методы хирургической коррекции.
При ведении больных с ОА врач сталкивается со многими трудностями, которые связаны преимущественно с пожилым возрастом больных, у которых, как правило, наблюдается несколько сопутствующих заболеваний. Все они требуют соответствующего лечения, а это, в свою очередь, приводит к полипрагмазии и проблеме лекарственных взаимодействий [9]. Следует иметь в виду, что для пожилых людей характерно увеличение частоты и выраженности нежелательных явлений (НЯ) при приеме лекарств, с другой, им требуется длительное лечение на протяжении многих месяцев и лет.
Медикаментозные препараты, используемые в терапии ОА, делятся на две основные группы: быстродействующие и медленнодействующие симптом-модифицирующие. Препараты первой группы направлены на подавление боли и нормализацию функции пораженных суставов. К ним относятся нестероидные противовоспалительные препараты (НПВП), анальгетики (простые и опиоидные), миорелаксанты, а также глюкокортикоиды. Что же касается препаратов второй группы, то они не только обладают симптом-модифицирующим эффектом, но способны контролировать течение заболевания, замедлять темпы его прогрессирования, стабилизировать структурные изменения в гиалиновом хряще и предупреждать развитие ОА в интактных суставах. Эти препараты рассматриваются как препараты патогенетического (базисного, хондромодулирующего) действия при ОА.
Назначение у больных ОА НПВП обосновано персистированием воспалительного процесса в суставах и периартикулярных мягких тканях. Однако следует отметить, что эти препараты активно вмешиваются в метаболизм хряща, в основном снижая синтез протеогликанов, коллагена II типа и гиалуроновой кислоты, и, таким образом, способствуют нарастанию структурных изменений. Необходимо упомянуть также широкий спектр НЯ, которые наблюдаются при приеме НПВП, особенно у лиц пожилого и старческого возраста.
Среди симптом-модифицирующих препаратов замедленного действия первостепенная роль принадлежит естественным компонентам хрящевого межклеточного вещества – глюкозамину сульфату и хондроитину сульфату, которые являются наиболее изученными среди ЛС этой группы [10−12]. Эти противоартрозные средства характеризуются медленным развитием лечебного эффекта, который обычно наступает после 2–4-х недель терапии, выраженным последействием в течение 4–8 и более недель после прекращения их приема (схема 1).
Схема 1.
Биологические эффекты препаратов с хондропротективной активностью
• Стимулируют синтез хондроцитами макромолекул матрикса хряща (гликозаминогликанов, протеогликанов, коллагена, протеинов, РНК, ДНК);
• Увеличивают синтез хондроцитами гиалуроновой кислоты;
• Снижают активность лизосомальных ферментов;
• Ингибируют деградацию хряща;
• Уменьшают интенсивность болей в суставах;
• Приводят к обратному развитию воспаления в тканях сустава;
• Увеличивают резистентность хондроцитов к воздействию провоспалительных цитокинов;
• Увеличивают устойчивость хондроцитов к негативному воздействию НПВП;
• Создают предпосылки для формирования устойчивого хряща.
В настоящее время существуют различные точки зрения относительно прямого хондропротективного действия структурных аналогов хряща. Все больше исследователей считают, что т. н. хондропротективные препараты не столько стимулируют синтез матрикса хряща, т. е. протеогликанов, гликозаминогликанов и гиалуроновой кислоты, хондроцитами, сколько обладают противовоспалительным действием, которое реализуется при их длительном применении. Различие взглядов на данную проблему во многом связано с отсутствием высокоинформативных методов, которые позволят адекватно судить о сохранности хрящевой ткани и отсутствии прогрессирования ОА на фоне хондропротективной терапии.
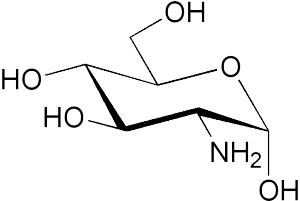
Наиболее солидную доказательную базу имеет глюкозамина сульфат [13, 16, 17]. Он является моносахаридом и естественным компонентом гликозаминогликанов суставного матрикса и синовиальной жидкости. Глюкозамин сульфат обладает специфическим влиянием на остеоартритический хрящ и стимулирует синтез хондроцитами полноценного экстрацеллюлярного матрикса, прежде всего наиболее важных его составляющих – протеогликанов и гиалуроновой кислоты. Он достоверно снижает активность катаболических энзимов в хряще, включая матриксные ММП, подавляет синтез оксида азота, стимулирует синтез хондроитинсерной кислоты. Сульфаты, содержащиеся в молекуле этого соединения, способствуют образованию гликозаминогликанов, а сульфидные эфиры боковых цепей в составе протеогликанов поддерживают эластичность хряща и удерживают воду матриксом хряща.
В систематическом Кокрановском обзоре, в котором анализировались наиболее значимые исследования по изучению эффективности и переносимости глюкозамина сульфата, дана высокая оценка его симптоматического действия [17]. Эффективность глюкозамина сульфата достоверно выше по сравнению с плацебо в плане уменьшения интенсивности болей в суставах, улучшения индекса Лекена, а также процента больных, ответивших на проводимую терапию. В то же время не получено достоверных результатов при сравнительной оценке эффективности глюкозамина сульфат и плацебо по таким параметрам, как скованность и улучшение функциональной способности суставов.
Структурно-модифицирующий эффект этого препарата был изучен в двух контролируемых исследованиях [13−15]. В первом из них было рандомизировано 212 больных с гонартрозом на две группы, которые регулярно принимали глюкозамина сульфат или плацебо в течение 3 лет. Ширина суставной щели увеличилась к концу исследования на 0,12 мм в основной группе, в то время как в группе плацебо она уменьшилась на 0,24 мм (рис. 3). Эти данные свидетельствуют о структурно-модифицирующем действии этого препарата и его способности активно воздействовать на темпы прогрессирования ОА. Однако далеко не у всех больных при многолетнем лечении этим препаратом наблюдалось снижение темпов рентгенологического прогрессирования. После трехлетнего непрерывного приема глюкозамина сульфат быстрое прогрессирование заболевания отмечено у 15% больных, при этом сужение суставной щели превышало 0,5 мм. Факторы риска такого агрессивного течения ОА пока не идентифицированы. Следует также отметить, что терапевтическая активность глюкозамина сульфат показана только у больных с гонартрозом, но не коксартрозом. Структурно-модифицирующий эффект глюкозамина сульфат подтверждается результатами длительного 8-летнего наблюдения за больными, которые лечились этим препаратом в течение первых 3 лет. В последующие 5 лет в эндопротезировании коленного сустава нуждалось 10,2% больных основной группы и 14,5% контрольной, принимающих плацебо.
Другой структурный аналог хряща – хондроитина сульфат также относится к симптоматическим медленнодействующим препаратам. Он является важным структурным компонентом основного вещества хрящевой ткани и входит в состав протеогликанов, во многом осуществляя механическую функцию сустава, в частности резистентность к компрессии [18, 19, 21].Действие хондроитина сульфата у больных с ОА является результатом большого комплекса биологических реакций, включая его антивоспалительную активность, стимуляцию синтеза протеогликанов, коллагена и гиалуроновой кислоты, а также снижение катаболической активности хондроцитов, ингибирующих синтез протеолитических энзимов, оксида азота и других субстанций. Хондроитина сульфат улучшает трофику и уменьшает резорбцию субхондральной кости, определяет вязкость синовиальной жидкости и эластичность хряща. Следует отметить также его влияние на метаболизм субхондральной кости, гидрофобность и стимуляцию синтеза гиалуроновой кислоты, что способствует осуществлению хрящом своей основной функции. Рациональное его использование в качестве лекарственного препарата основано на известном факте, что ОА ассоциируется с локальным дефицитом некоторых естественных субстанций, включая хондроитина сульфат. Доказано, что его биологическая активность осуществляется путем воздействия на NF-kB (один из главных регуляторов воспалительного ответа), снижения экспрессии ИЛ-1β хондроцитами и синовиоцитами, снижения концентрации провоспалительных молекул (СРБ, ИЛ-6), ингибиции экспрессии ЦОГ-2.
Уровень доказательности хондроитина сульфата в отношении модификации симптомов ОА является таким же высоким, как и у глюкозамина сульфат (IA), что нашло свое отображение в рекомендациях как Европейской антиревматической лиги (EULAR), так и Международного общества по изучению остеоартроза (OARSI) [20]. Он обладает выраженным симптом-модифицирующим эффектом (уменьшает суставную боль и скованность, улучшает функцию пораженных суставов) и тормозит прогрессирование ОА, что убедительно доказано по динамике ширины суставной щели. В рандомизированном исследовании STOPP Каhan A. и соавт. оценивали прогрессирование гонартроза при приеме хондроитина сульфата [22]. В исследование было включено 622 больных, которые принимали или хондроитина сульфат (основная группа), или плацебо (контрольная группа) в течение двух лет (рис. 2). В основной группе зарегистрировано менее выраженное сужение суставной щели по сравнению с контрольной (-0,07 и 0,31 мм, соответственно, р < 0,0005) и было меньше больных с рентгенологическим прогрессированием ≥ 0,25 мм по сравнению с плацебо (28 против 41%; р < 0,0005). Это исследование также показало, что интенсивность боли в суставах лучше контролировалась применением хондроитина, чем плацебо (р < 0,001). Структурно-модифицирующее действие хондроитина сульфата связывают с повышением вязкости синовиальной жидкости, увеличением синтеза эндогенной гиалуроновой кислоты, а также с влиянием на метаболизм гиалинового хряща, которое проявляется в стимуляции синтеза протеогликанов, ингибиции энзимов деструкции хряща ММР-3,-9,-13,-14, эластазы, катепсина-β, ингибировании медиаторов воспаления: ИЛ-1, ЦОГ-2, ПГЕ2, NF-kB, снижении апоптоза, концентрации оксида азота и свободных радикалов [23].
Существуют комбинированные препараты, в которые входят глюкозамина сульфат (или гидрохлорид) и хондроитина сульфат. Целесообразность их применения показана экспериментальными и клиническими данными. Такие препараты на модели ОА у кроликов способствовали нарастанию синтеза глюкозаминогликанов хондроцитами на 96,6%, а на фоне монотерапии симптом-модифицирующими средствами замедленного действия – только на 32% [24]. На фоне комбинированной терапии поражение хряща было также менее тяжелым по сравнению с применением монопрепаратов глюкозамина или хондроитина. Следует иметь в виду, что структурные аналоги хряща имеют не только общие, но и отличительные механизмы своего влияния на боль и воспаление. В то же время они являются синергистами и при совместном применении дополняют и усиливают действие друг друга.
К комбинированным препаратам с хондропротективной активностью относится Терафлекс [Bayer, Германия]. Он включает 500 мг глюкозамина гидрохлорида и 400 мг хондроитина сульфата и назначается по 2 капсулы 2 раза в день на протяжении первых 4 нед., а затем по 2 капсулы в день. Длительность приема должна составлять не менее 6 мес. Эффективность препарата повышается при его длительном (многомесячном и многолетнем) приеме. Учитывая наличие последействия препарата, его можно назначать повторными 6-месячными курсами с последующим перерывом на 3–6 мес. Существуют различные мнения об эффективности отдельных cолей глюкозамина. Некоторые авторы полагают, что только глюкозамину сульфат присуще симптом-модифицирующее и структурно-модифицирующее действие. В других исследованиях подчеркивается, что глюкозамин гидрохлорид и глюкозамин сульфат обладают одинаковой эффективностью [25].
Целесообразность комбинации двух основных препаратов с хондропротективной активностью объясняется возможностью потенцирования положительного эффекта каждого из них, что связано с особенностями фармакологического действия глюкозамина и хондроитина. Как известно, хондроитина сульфат и глюкозамина сульфат оказывают многообразное, но не во всем идентичное действие на боль и воспаление в тканях сустава, в частности гиалиновом хряще, субхондральной кости и синовиальной оболочке. Они являются синергистами, дополняя и усиливая действие друг друга. В эксперименте на культуре хондроцитов лошади было показано, что глюкозамина гидрохлорид подавлял продукцию окиси углерода и простагландина Е2, в то время как хондроитина сульфат не влиял на продукцию простагландина Е2. В то же время комбинация этих солей уменьшала активность ММР-9 и ММР-13, т. е. медиаторов деградации хряща [26].
Терафлекс обладает противовоспалительным, анальгетическим и хондропротективным действием, о чем свидетельствуют результаты многочисленных исследований. В открытом рандомизированном исследовании Терафлекса, проведенном в Институте ревматологии РАМН, подтверждены эффективность и безопасность применения этого хондроактивного препарата [27]. В исследование вошло 100 пациентов с гонартрозом, из них 50 пациентов принимали ежедневно Терафлекс в течение 9 мес. (1 группа) и 50 больных – по следующей схеме: 3 мес. − прием, 3 мес. − перерыв, 3 мес. − прием. После 9-месячного курса терапии проводилась оценка последействия препарата в течение 3 мес. Помимо Терафлекса все больные получали ибупрофен по 400 мг 3 раза в сутки.
К клеточным факторам относятся хондроциты гиалинового хряща, остеоциты и остеобласты субхондральной кости, синовиоциты и мононуклеарные клетки синовиальной оболочки. Растворимые медиаторы вырабатываются хондроцитами, а также синовиоцитами и инфильтрирующими мононуклеарными клетками. К ним относятся провоспалительные цитокины, протеиназы, оксид азота и липидные медиаторы (лептин, адипонектин, вистатин, резистин). Адипокины являются новым классом растворимых медиаторов, которые участвуют в деградации хряща. Субхондральные остеобласты также способны продуцировать растворимые медиаторы, такие как инсулиновый фактор роста 1 (IGF-1), трансформирующий фактор роста − бета (TGF-β), ИЛ-6, липидные медиаторы, протеиназы, фрагменты фибронектина и нейропептиды.
Хотя ОА считается основным дегенеративным заболеванием суставов, в последнее время появляются убедительные данные, позволяющие рассматривать его как нозологическую форму, в патогенезе которой важнейшую роль играет персистирующее воспаление в тканях сустава [6, 7]. Такое воспаление cпособствует прогрессированию морфологических изменений, в т. ч. структурных изменений гиалинового хряща с его дегенерацией и уменьшением объема. Интересно, что на Европейском конгрессе ревматологов в 2012 г. обсуждалась целесообразность назначения больным ОА низких доз преднизолона, метотрексата и ингибиторов ФНО-α.
В настоящее время получены веские доказательства, подтверждающие влияние провоспалительных медиаторов на метаболизм клеток гиалинового хряща и течение ОА [8]. Среди медиаторов, ответственных за прогрессирование этого заболевания, ключевое значение имеет IL-1β, который экспрессируется в пораженном ОА хряще и стимулирует выработку металлопротеиназ (ММП) (рис. 2). В реализации деструкции хряща при первичном ОА решающее значение имеет гиперпродукция хондроцитами и другими клетками ММП, включая коллагеназы (ММП-1, 8, 13), аггреканазы (ADAM-TS4 и TS5), стромелизина-1 (ММР-3) и желатиназы (ММР-2, 9). IL-1β тормозит экспрессию ингибиторов ММП, синтез коллагена и протеогликанов, экспрессирует активатор плазминогена и в то же время стимулирует синтез и высвобождение некоторых эйкозаноидов, в т. ч. простагландинов и лейкотриенов [7]. Он стимулирует продукцию других провоспалительных цитокинов (IL-6, IL-8) и определяет уровень катаболического процесса при ОА.
В развитии ОА участвуют и другие члены суперсемейства IL-1, фактор некроза опухоли-α (TNF-α), IL-6, IL-17, IL-18, онкостатин М (OSM), фактор ингибиции лейкемии (LIF). Cодержание TNF-α существенно ниже при ОА, чем при ревматоидном артрите, но при тяжелом течении ОА его значения достоверно выше, чем у здоровых лиц. Существенную роль в развитии воспаления у больных ОА отводят онкостатину М (цитокин семейства IL-6). В эксперименте показано, что он способствует высвобождению из гиалинового хряща протеогликанов, стромелизина-1 и коллагена. ОSM усиливает активность других провоспалительных медиаторов, включая IL-6. В свою очередь, IL-6 индуцирует синтез тканевых ингибиторов матриксных ММП, IL-1Ra и растворимого рецептора TNF. Роль IL-18 в патогенезе ОА подтверждается наличием его в биоптатах гиалинового хряща и синовиальной оболочки, полученных от больных ОА.
В патогенезе ОА принимают участие также ряд других медиаторов воспаления. При остеоартрозе в гиалиновом хряще повышается продукция оксида азота, который определяется в синовиальной жидкости и сыворотке крови. Хорошо известна биологическая активность простагландинов. Наиболее изученный PGE2 способствует повреждению тканей сустава путем потенцирования ММП и других медиаторов воспаления. Он тормозит репарацию поврежденного хряща и индуцирует его фибропластическую дегенерацию, стимулирует остеокластическую костную резорбцию и ангиогенез. Однако только ингибиция PGE2 не замедляет прогрессирование ОА. Известно, что синтез PGE2 является лишь одной из составных частей метаболизма арахидоновой кислоты, из которой образуются и многие другие медиаторы, в частности лейкотриены. Лейкотриены также участвуют в персистенции воспалительного процесса независимо от простагландинов. Лейкотриены, например LTB4 или LTC4, потенцируют хемотаксис воспалительных факторов и стимулируют высвобождение провоспалительных цитокинов, таких как IL-1β и TNF-α. В каскаде воспалительных медиаторов, играющих значительную роль в развитии структурных изменений при ОА, принимают участие протеазоактивированные рецепторы (PARs), прежде всего PAR-2.
Медикаментозная терапия остеоартроза
Эффективная терапия данного заболевания представляет сложную задачу, что связано с хроническим и неуклонно прогрессирующим течением этого заболевания, подчас без каких-либо видимых предрасполагающих факторов. Лечение должно быть направлено на профилактику прогрессирования заболевания и предупреждение серьезных структурных изменений в тканях сустава. Выполнение этой задачи требует проведения комплексной и длительной, практически постоянной терапии с включением немедикаментозных и медикаментозных методов, воздействующих на главные звенья патогенеза ОА. При планировании рациональной терапии следует иметь в виду коморбидные заболевания, которые нередко наблюдаются при ОА и существенно влияют на его прогноз.
Основные направления лечения остеоатроза:
§ устранение внешних причин, способствующих его развитию и прогрессированию;
§ воздействие на проявления реактивного артрита и воспаления в других тканях сустава, что предусматривает проведение антивоспалительной терапии;
§ нормализация или позитивное влияние на нарушенный метаболизм суставного хряща, что обеспечивает симптоматическая медленнодействующая (хондроактивная, хондропротективная) терапия;
§ восстановление функции пораженных суставов с использованием большого спектра реабилитационных мероприятий, включая методы хирургической коррекции.
При ведении больных с ОА врач сталкивается со многими трудностями, которые связаны преимущественно с пожилым возрастом больных, у которых, как правило, наблюдается несколько сопутствующих заболеваний. Все они требуют соответствующего лечения, а это, в свою очередь, приводит к полипрагмазии и проблеме лекарственных взаимодействий [9]. Следует иметь в виду, что для пожилых людей характерно увеличение частоты и выраженности нежелательных явлений (НЯ) при приеме лекарств, с другой, им требуется длительное лечение на протяжении многих месяцев и лет.
Медикаментозные препараты, используемые в терапии ОА, делятся на две основные группы: быстродействующие и медленнодействующие симптом-модифицирующие. Препараты первой группы направлены на подавление боли и нормализацию функции пораженных суставов. К ним относятся нестероидные противовоспалительные препараты (НПВП), анальгетики (простые и опиоидные), миорелаксанты, а также глюкокортикоиды. Что же касается препаратов второй группы, то они не только обладают симптом-модифицирующим эффектом, но способны контролировать течение заболевания, замедлять темпы его прогрессирования, стабилизировать структурные изменения в гиалиновом хряще и предупреждать развитие ОА в интактных суставах. Эти препараты рассматриваются как препараты патогенетического (базисного, хондромодулирующего) действия при ОА.
Назначение у больных ОА НПВП обосновано персистированием воспалительного процесса в суставах и периартикулярных мягких тканях. Однако следует отметить, что эти препараты активно вмешиваются в метаболизм хряща, в основном снижая синтез протеогликанов, коллагена II типа и гиалуроновой кислоты, и, таким образом, способствуют нарастанию структурных изменений. Необходимо упомянуть также широкий спектр НЯ, которые наблюдаются при приеме НПВП, особенно у лиц пожилого и старческого возраста.
Среди симптом-модифицирующих препаратов замедленного действия первостепенная роль принадлежит естественным компонентам хрящевого межклеточного вещества – глюкозамину сульфату и хондроитину сульфату, которые являются наиболее изученными среди ЛС этой группы [10−12]. Эти противоартрозные средства характеризуются медленным развитием лечебного эффекта, который обычно наступает после 2–4-х недель терапии, выраженным последействием в течение 4–8 и более недель после прекращения их приема (схема 1).
Схема 1.
Биологические эффекты препаратов с хондропротективной активностью
• Стимулируют синтез хондроцитами макромолекул матрикса хряща (гликозаминогликанов, протеогликанов, коллагена, протеинов, РНК, ДНК);
• Увеличивают синтез хондроцитами гиалуроновой кислоты;
• Снижают активность лизосомальных ферментов;
• Ингибируют деградацию хряща;
• Уменьшают интенсивность болей в суставах;
• Приводят к обратному развитию воспаления в тканях сустава;
• Увеличивают резистентность хондроцитов к воздействию провоспалительных цитокинов;
• Увеличивают устойчивость хондроцитов к негативному воздействию НПВП;
• Создают предпосылки для формирования устойчивого хряща.
В настоящее время существуют различные точки зрения относительно прямого хондропротективного действия структурных аналогов хряща. Все больше исследователей считают, что т. н. хондропротективные препараты не столько стимулируют синтез матрикса хряща, т. е. протеогликанов, гликозаминогликанов и гиалуроновой кислоты, хондроцитами, сколько обладают противовоспалительным действием, которое реализуется при их длительном применении. Различие взглядов на данную проблему во многом связано с отсутствием высокоинформативных методов, которые позволят адекватно судить о сохранности хрящевой ткани и отсутствии прогрессирования ОА на фоне хондропротективной терапии.
Наиболее солидную доказательную базу имеет глюкозамина сульфат [13, 16, 17]. Он является моносахаридом и естественным компонентом гликозаминогликанов суставного матрикса и синовиальной жидкости. Глюкозамин сульфат обладает специфическим влиянием на остеоартритический хрящ и стимулирует синтез хондроцитами полноценного экстрацеллюлярного матрикса, прежде всего наиболее важных его составляющих – протеогликанов и гиалуроновой кислоты. Он достоверно снижает активность катаболических энзимов в хряще, включая матриксные ММП, подавляет синтез оксида азота, стимулирует синтез хондроитинсерной кислоты. Сульфаты, содержащиеся в молекуле этого соединения, способствуют образованию гликозаминогликанов, а сульфидные эфиры боковых цепей в составе протеогликанов поддерживают эластичность хряща и удерживают воду матриксом хряща.
В систематическом Кокрановском обзоре, в котором анализировались наиболее значимые исследования по изучению эффективности и переносимости глюкозамина сульфата, дана высокая оценка его симптоматического действия [17]. Эффективность глюкозамина сульфата достоверно выше по сравнению с плацебо в плане уменьшения интенсивности болей в суставах, улучшения индекса Лекена, а также процента больных, ответивших на проводимую терапию. В то же время не получено достоверных результатов при сравнительной оценке эффективности глюкозамина сульфат и плацебо по таким параметрам, как скованность и улучшение функциональной способности суставов.
Структурно-модифицирующий эффект этого препарата был изучен в двух контролируемых исследованиях [13−15]. В первом из них было рандомизировано 212 больных с гонартрозом на две группы, которые регулярно принимали глюкозамина сульфат или плацебо в течение 3 лет. Ширина суставной щели увеличилась к концу исследования на 0,12 мм в основной группе, в то время как в группе плацебо она уменьшилась на 0,24 мм (рис. 3). Эти данные свидетельствуют о структурно-модифицирующем действии этого препарата и его способности активно воздействовать на темпы прогрессирования ОА. Однако далеко не у всех больных при многолетнем лечении этим препаратом наблюдалось снижение темпов рентгенологического прогрессирования. После трехлетнего непрерывного приема глюкозамина сульфат быстрое прогрессирование заболевания отмечено у 15% больных, при этом сужение суставной щели превышало 0,5 мм. Факторы риска такого агрессивного течения ОА пока не идентифицированы. Следует также отметить, что терапевтическая активность глюкозамина сульфат показана только у больных с гонартрозом, но не коксартрозом. Структурно-модифицирующий эффект глюкозамина сульфат подтверждается результатами длительного 8-летнего наблюдения за больными, которые лечились этим препаратом в течение первых 3 лет. В последующие 5 лет в эндопротезировании коленного сустава нуждалось 10,2% больных основной группы и 14,5% контрольной, принимающих плацебо.
Другой структурный аналог хряща – хондроитина сульфат также относится к симптоматическим медленнодействующим препаратам. Он является важным структурным компонентом основного вещества хрящевой ткани и входит в состав протеогликанов, во многом осуществляя механическую функцию сустава, в частности резистентность к компрессии [18, 19, 21].Действие хондроитина сульфата у больных с ОА является результатом большого комплекса биологических реакций, включая его антивоспалительную активность, стимуляцию синтеза протеогликанов, коллагена и гиалуроновой кислоты, а также снижение катаболической активности хондроцитов, ингибирующих синтез протеолитических энзимов, оксида азота и других субстанций. Хондроитина сульфат улучшает трофику и уменьшает резорбцию субхондральной кости, определяет вязкость синовиальной жидкости и эластичность хряща. Следует отметить также его влияние на метаболизм субхондральной кости, гидрофобность и стимуляцию синтеза гиалуроновой кислоты, что способствует осуществлению хрящом своей основной функции. Рациональное его использование в качестве лекарственного препарата основано на известном факте, что ОА ассоциируется с локальным дефицитом некоторых естественных субстанций, включая хондроитина сульфат. Доказано, что его биологическая активность осуществляется путем воздействия на NF-kB (один из главных регуляторов воспалительного ответа), снижения экспрессии ИЛ-1β хондроцитами и синовиоцитами, снижения концентрации провоспалительных молекул (СРБ, ИЛ-6), ингибиции экспрессии ЦОГ-2.
Уровень доказательности хондроитина сульфата в отношении модификации симптомов ОА является таким же высоким, как и у глюкозамина сульфат (IA), что нашло свое отображение в рекомендациях как Европейской антиревматической лиги (EULAR), так и Международного общества по изучению остеоартроза (OARSI) [20]. Он обладает выраженным симптом-модифицирующим эффектом (уменьшает суставную боль и скованность, улучшает функцию пораженных суставов) и тормозит прогрессирование ОА, что убедительно доказано по динамике ширины суставной щели. В рандомизированном исследовании STOPP Каhan A. и соавт. оценивали прогрессирование гонартроза при приеме хондроитина сульфата [22]. В исследование было включено 622 больных, которые принимали или хондроитина сульфат (основная группа), или плацебо (контрольная группа) в течение двух лет (рис. 2). В основной группе зарегистрировано менее выраженное сужение суставной щели по сравнению с контрольной (-0,07 и 0,31 мм, соответственно, р < 0,0005) и было меньше больных с рентгенологическим прогрессированием ≥ 0,25 мм по сравнению с плацебо (28 против 41%; р < 0,0005). Это исследование также показало, что интенсивность боли в суставах лучше контролировалась применением хондроитина, чем плацебо (р < 0,001). Структурно-модифицирующее действие хондроитина сульфата связывают с повышением вязкости синовиальной жидкости, увеличением синтеза эндогенной гиалуроновой кислоты, а также с влиянием на метаболизм гиалинового хряща, которое проявляется в стимуляции синтеза протеогликанов, ингибиции энзимов деструкции хряща ММР-3,-9,-13,-14, эластазы, катепсина-β, ингибировании медиаторов воспаления: ИЛ-1, ЦОГ-2, ПГЕ2, NF-kB, снижении апоптоза, концентрации оксида азота и свободных радикалов [23].
Существуют комбинированные препараты, в которые входят глюкозамина сульфат (или гидрохлорид) и хондроитина сульфат. Целесообразность их применения показана экспериментальными и клиническими данными. Такие препараты на модели ОА у кроликов способствовали нарастанию синтеза глюкозаминогликанов хондроцитами на 96,6%, а на фоне монотерапии симптом-модифицирующими средствами замедленного действия – только на 32% [24]. На фоне комбинированной терапии поражение хряща было также менее тяжелым по сравнению с применением монопрепаратов глюкозамина или хондроитина. Следует иметь в виду, что структурные аналоги хряща имеют не только общие, но и отличительные механизмы своего влияния на боль и воспаление. В то же время они являются синергистами и при совместном применении дополняют и усиливают действие друг друга.
К комбинированным препаратам с хондропротективной активностью относится Терафлекс [Bayer, Германия]. Он включает 500 мг глюкозамина гидрохлорида и 400 мг хондроитина сульфата и назначается по 2 капсулы 2 раза в день на протяжении первых 4 нед., а затем по 2 капсулы в день. Длительность приема должна составлять не менее 6 мес. Эффективность препарата повышается при его длительном (многомесячном и многолетнем) приеме. Учитывая наличие последействия препарата, его можно назначать повторными 6-месячными курсами с последующим перерывом на 3–6 мес. Существуют различные мнения об эффективности отдельных cолей глюкозамина. Некоторые авторы полагают, что только глюкозамину сульфат присуще симптом-модифицирующее и структурно-модифицирующее действие. В других исследованиях подчеркивается, что глюкозамин гидрохлорид и глюкозамин сульфат обладают одинаковой эффективностью [25].
Целесообразность комбинации двух основных препаратов с хондропротективной активностью объясняется возможностью потенцирования положительного эффекта каждого из них, что связано с особенностями фармакологического действия глюкозамина и хондроитина. Как известно, хондроитина сульфат и глюкозамина сульфат оказывают многообразное, но не во всем идентичное действие на боль и воспаление в тканях сустава, в частности гиалиновом хряще, субхондральной кости и синовиальной оболочке. Они являются синергистами, дополняя и усиливая действие друг друга. В эксперименте на культуре хондроцитов лошади было показано, что глюкозамина гидрохлорид подавлял продукцию окиси углерода и простагландина Е2, в то время как хондроитина сульфат не влиял на продукцию простагландина Е2. В то же время комбинация этих солей уменьшала активность ММР-9 и ММР-13, т. е. медиаторов деградации хряща [26].
Терафлекс обладает противовоспалительным, анальгетическим и хондропротективным действием, о чем свидетельствуют результаты многочисленных исследований. В открытом рандомизированном исследовании Терафлекса, проведенном в Институте ревматологии РАМН, подтверждены эффективность и безопасность применения этого хондроактивного препарата [27]. В исследование вошло 100 пациентов с гонартрозом, из них 50 пациентов принимали ежедневно Терафлекс в течение 9 мес. (1 группа) и 50 больных – по следующей схеме: 3 мес. − прием, 3 мес. − перерыв, 3 мес. − прием. После 9-месячного курса терапии проводилась оценка последействия препарата в течение 3 мес. Помимо Терафлекса все больные получали ибупрофен по 400 мг 3 раза в сутки.
 Положительный результат терапии в обеих группах наблюдался уже спустя 3 мес. от начала лечения, что проявлялось достоверным уменьшением интенсивности боли, длительности утренней скованности, суммарного индекса WOMAC, а также скорости ходьбы. Полученный эффект сохранялся в течение всего периода наблюдения, причем в одинаковой степени в оцениваемых группах. Полученные результаты показали равную эффективность постоянного и интермиттирующего приема препарата Терафлекс. Результаты данной работы и других исследований свидетельствуют о том, что достигнутый положительный лечебный эффект после 3–6 мес. приема этого препарата сохраняется и в дальнейшем в течение 6 мес. В этом исследовании была продемонстрирована хорошая переносимость и высокая безопасность Терафлекса, каких-либо серьезных нежелательных явлений не наблюдалось.
Интересные данные получены в долгосрочном испытании Терафлекса у 244 пациентов с ОА коленных суставов [28]. Исследовали 2 группы больных, которые были сопоставимы по основным параметрам заболевания. Пациенты 1-й группы (основной) принимали Терафлекс по общепринятой схеме в течение 6 мес., а затем препарат назначали повторными курсами по 2 капсулы /сут в течение 2 мес. с интервалом в 1 мес. Общая длительность терапии на момент окончания исследования составила 3 года. Пациенты контрольной группы применяли диклофенак по 100 мг/сут в сочетании с различными видами физиотерапии. При существенном уменьшении боли пациенты принимали НПВП только по потребности. Всем пациентам проводили рентгенографию коленных суставов в прямой, боковой и аксиальной проекции в положении максимального разгибания колена. Оценивали степень сужения суставной щели и выраженность остеофитоза полуколичественным методом.
За 3-летний период лечения Терафлексом различия в величине рентгенологической суставной щели по сравнению с исходными значениями не достигали статистической достоверности. Что касается выраженности остеофитоза, то наблюдалось незначительное повышение этого показателя через 1 год лечения и отсутствие достоверной динамики спустя 2–3 года терапии. Рентгенологическое прогрессирование к концу первого года терапии выявлено в 8,6% в основной группе и в 9,2% в контрольной, через 2 года – в 15,4% и 18,3% соответственно, а через 3 года терапии в 21,4% и 32,7%. Симптом-модифицирующее и структурно-модифицирующее действие такой комбинации глюкозамина гидрохлорида и хондроитина сульфата выявлено и в исследовании Richy, в котором учитывали динамику индекса WOMAC, величину суставной щели и нормализацию функциональной способности суставов [29].
Таким образом, глюкозамина сульфат/гидрохлорид и хондроитина сульфат являются основными базисными хондроактивными препаратами в лечении ОА с высоким уровнем доказательности. Эти фармакологические агенты обладают противовоспалительным и обезболивающим действием, а при длительном применении способны тормозить прогрессирование ОА. Терафлекс – комбинированный противоартрозный препарат, в котором глюкозамина гидрохлорид и хондроитина сульфат являются синергистами, усиливающими и дополняющими фармакологическое действие каждой соли в отдельности. Представленные данные позволяют рассматривать Терафлекс не только как симптом-модифицирующий и структурно-модифицирующий препарат, но и как средство патогенетической терапии остеоартроза.
Источник: http://www.remedium.ru/drugs/detail.php?ID=64650
Положительный результат терапии в обеих группах наблюдался уже спустя 3 мес. от начала лечения, что проявлялось достоверным уменьшением интенсивности боли, длительности утренней скованности, суммарного индекса WOMAC, а также скорости ходьбы. Полученный эффект сохранялся в течение всего периода наблюдения, причем в одинаковой степени в оцениваемых группах. Полученные результаты показали равную эффективность постоянного и интермиттирующего приема препарата Терафлекс. Результаты данной работы и других исследований свидетельствуют о том, что достигнутый положительный лечебный эффект после 3–6 мес. приема этого препарата сохраняется и в дальнейшем в течение 6 мес. В этом исследовании была продемонстрирована хорошая переносимость и высокая безопасность Терафлекса, каких-либо серьезных нежелательных явлений не наблюдалось.
Интересные данные получены в долгосрочном испытании Терафлекса у 244 пациентов с ОА коленных суставов [28]. Исследовали 2 группы больных, которые были сопоставимы по основным параметрам заболевания. Пациенты 1-й группы (основной) принимали Терафлекс по общепринятой схеме в течение 6 мес., а затем препарат назначали повторными курсами по 2 капсулы /сут в течение 2 мес. с интервалом в 1 мес. Общая длительность терапии на момент окончания исследования составила 3 года. Пациенты контрольной группы применяли диклофенак по 100 мг/сут в сочетании с различными видами физиотерапии. При существенном уменьшении боли пациенты принимали НПВП только по потребности. Всем пациентам проводили рентгенографию коленных суставов в прямой, боковой и аксиальной проекции в положении максимального разгибания колена. Оценивали степень сужения суставной щели и выраженность остеофитоза полуколичественным методом.
За 3-летний период лечения Терафлексом различия в величине рентгенологической суставной щели по сравнению с исходными значениями не достигали статистической достоверности. Что касается выраженности остеофитоза, то наблюдалось незначительное повышение этого показателя через 1 год лечения и отсутствие достоверной динамики спустя 2–3 года терапии. Рентгенологическое прогрессирование к концу первого года терапии выявлено в 8,6% в основной группе и в 9,2% в контрольной, через 2 года – в 15,4% и 18,3% соответственно, а через 3 года терапии в 21,4% и 32,7%. Симптом-модифицирующее и структурно-модифицирующее действие такой комбинации глюкозамина гидрохлорида и хондроитина сульфата выявлено и в исследовании Richy, в котором учитывали динамику индекса WOMAC, величину суставной щели и нормализацию функциональной способности суставов [29].
Таким образом, глюкозамина сульфат/гидрохлорид и хондроитина сульфат являются основными базисными хондроактивными препаратами в лечении ОА с высоким уровнем доказательности. Эти фармакологические агенты обладают противовоспалительным и обезболивающим действием, а при длительном применении способны тормозить прогрессирование ОА. Терафлекс – комбинированный противоартрозный препарат, в котором глюкозамина гидрохлорид и хондроитина сульфат являются синергистами, усиливающими и дополняющими фармакологическое действие каждой соли в отдельности. Представленные данные позволяют рассматривать Терафлекс не только как симптом-модифицирующий и структурно-модифицирующий препарат, но и как средство патогенетической терапии остеоартроза.
Источник: http://www.remedium.ru/drugs/detail.php?ID=64650
Сетевое издание PHARMEDU (18+) зарегистрировано в Роскомнадзоре 12.07.2019 г.
Номер свидетельства Эл №ФС77-76297.
Учредитель — Общество с ограниченной ответственностью «ФАРМЕДУ» (ОГРН 1185074012881).
Главный редактор — Т. Ю. Ходанович. Тел: +7 (495) 120-44-34, email: hello@pharmedu.ru
Публикация № P-16618
Главный редактор — Т. Ю. Ходанович. Тел: +7 (495) 120-44-34, email: hello@pharmedu.ru
Публикация № P-16618